Еще в V веке до нашей эры греческие мыслители Левкипп и Демокрит сформулировали результаты своих размышлений о структуре материи в виде атомистической гипотезы: вещество невозможно бесконечно делить на все более мелкие части, существуют «окончательные», неделимые частицы вещества. Все материальные предметы состоят из разнообразных атомов (от греч. atomos — «неделимый», «неразрезаемый»). Соединяясь, различные типы атомов, образуют все новые вещества.
По легенде, Демокрит, сидя у моря на камне, держал в руке яблоко и размышлял: «Если я буду резать это яблоко ножом на все более мелкие части, всегда ли у меня в руках будет оставаться часть, которая все еще имеет свойства яблока?» Обдумав эту гипотезу, Демокрит пришел к следующим выводам: «Начало Вселенной - атомы и пустота, все же остальное существует лишь во мнении. Миров - бесчисленное множество, и они имеют начало и конец во времени. И ничто не возникает из небытия, не разрешается в небытие. И атомы бесчисленны по величине и множеству, носятся же они во вселенной, кружась в вихре, и таким образом рождается все сложное: огонь, вода, воздух, земля… Атомы же не поддаются никакому воздействию и неизменяемы вследствие твердости».
Впрочем, есть сведения, что уже в VII веке до н.э. в системе знаний индийского мудреца Канады материальная субстанция строилась из атомов, которые соединялись попарно. В качестве связующих сил предполагалось наличие «воли Бога или еще чего-либо». Очень интересно, что о существовании атомов мудрец считал возможным узнать «не восприятием, а рассуждением» (Бейлин В.А. и др., 2001).
На начало 19 века приходится становление теории атомно-молекулярного строения мира. Доказать экспериментально, что каждый химический элемент состоит из одинаковых атомов, удалось лишь в 1808 г.
 Сделал это английский химик и физик Джон Даль-
Сделал это английский химик и физик Джон Даль-
тон, вошедший в историю как создатель химического атомизма. Кстати он впервые описал дефект зрения, которым страдал сам, получивший название дальто-
низма (1794). Как известно, он связан с нарушением нормального цветоощущения. Сам Дальтон представ-
лял атомы в виде упругих шариков и настолько верил в их реальное существование, что даже рисовал на бума-
Дж. Дальтон ге атомы кислорода и азота.
(1766 - 1844)
Тем не менее, результаты экспериментов Дальтона и других исследователей для многих ученых еще долгое время не являлись убедительными. Даже в начале ХХ века известный физик и философ Эрнст Мах с издёвкой спрашивал у приверженцев атомной теории: «А вы видели хоть один атом?».
 В 1811 г. итальянский физик и химик Амедео Авогадро выдвинул гипотезу, согласно которой молекулы простых газов состоят из одного или нескольких атомов. На основе этой гипотезы Авогадро дал фор-
В 1811 г. итальянский физик и химик Амедео Авогадро выдвинул гипотезу, согласно которой молекулы простых газов состоят из одного или нескольких атомов. На основе этой гипотезы Авогадро дал фор-
мулировку одного из основных законов идеальных газов и способ определения атомных и молекулярных масс. Однако молекулярная гипотеза А.Авогадро не была принята большинством физиков и химиков пер-
А.Авогадро (1776 - 1856) вой половины XIX века.
Он открыл один из газовых законов, названный его именем. На его осно-
ве был разработан метод определения молекулярного и атомного весов. Авогадро стал автором четырехтомного труда «Физика весовых тел, или трактат об общей конституции тел» (1837-1841 г.г.), который стал первым руковод-
ством по молекулярной физике.
Итак, все вещества в природе состоят из атомов. Их принято делить на
простые, состоящие из атомов одних и тех же элементов (О2, N2, H2 и т.д.),
и сложные, в состав которых входят атомы различных элементов (H2O, NaCl,
H2SO4 и др.).
Атом – это наименьшее структурное образование любого из простейших химических веществ, называемых элементами. Хотя понятие атома, как и сам термин, имеет древнегреческое происхождение, только в ХХ веке была твердо установлена истинность атомной гипотезы строения веществ.
Размер и масса атомов чрезвычайно малы. Так, диаметр самого легкого атома (водорода) составляет всего 0,53 . 10 -8 см, а его масса 1,67. 10- 24 г.
Развитие исследований радиоактивного излучения, с одной стороны, и квантовой теории - с другой, привели к созданию квантовой модели атома Резерфорда - Бора. Но созданию этой модели предшествовали попытки построить модель атома на основе представлений классической электродинамики и механики.
 После открытия электрона в 1897 г. Джозефом Джоном Томсоном (Нобелевская премия по физике, 1906) он обнаружил, что от атомов под действием сильного электрического поля отрываются заряженные частицы. По его оценкам, масса «атома электри-
После открытия электрона в 1897 г. Джозефом Джоном Томсоном (Нобелевская премия по физике, 1906) он обнаружил, что от атомов под действием сильного электрического поля отрываются заряженные частицы. По его оценкам, масса «атома электри-
чества» примерно в тысячу раз меньше массы атома водорода, а заряд точно совпадает с зарядом иона
Дж.Томсон (1856-1940) водорода.
Позднее, уже в 1910 и 1913 г.г., Роберт Милликен намного повысил точность измерений заряда и массы электрона. Хотя и по отношению к существованию самого электрона находились скептики. Так, знаменитый в свое время физик Оливер Лодж указывал в 1902 г: «Электрон - это чисто гипотетический заряд, изолированный от атома». Так, несмотря на отдельные мнения, к концу XIX века стало понятно, что частицы, еще меньшие, чем атомы, существуют реально, и что, скорее всего, они входят в состав атомов и являются носителями некоторого наименьшего количества электричества.
Важно, однако, то, что только через 100 лет после воскрешения атомных представлений, Уильям Томсон создал первую модель строения атома, в которой
предполагалось, что электроны занимают внешнюю часть атома.
Джозеф Томсон, развивая модель У.Томсона, в 1903 г. предлагает свою модель атома («пудинга с изюмом»): в положительную сферу вкраплены электроны. Они удерживаются внутри положительно заряженной сферы упругими силами. Те из них,которые находятся на поверхности, могут довольно легко «выбиваться», оставляя ионизованный атом (рис. 9).
Рис. 9. Модель строения атома Дж.Томсона
В многоэлектронных атомах электроны располагаются по устойчивым конфигурациям, рассчитанным Томсоном. Он считал каждую такую конфигурацию определяющей химические свойства атомов. Дж. Томсон предпринял попытку теоретически объяснить периодическую систему элементов Д.И. Менделеева.
Позднее Нильс Бор указал, что со времени этой попытки идея о разделении электронов в атоме на группы сделалась исходным пунктом. В 1911 г. Джозеф Томсон разработал так называемый метод парабол для измерения отношения заряда частицы к её массе,который сыграл большую роль в исследовании изотопов.
В 1903 г. с идеей о планетарной модели строения атома в Токийском физико-математическом обществе выступил японский теоретик Хантаро Нагаока, назвавший эту модель «сатурноподобной».
 Х.Нагаока представил строение атома аналогичным строению солнечной системы: роль Солнца играет
Х.Нагаока представил строение атома аналогичным строению солнечной системы: роль Солнца играет
положительно заряженная центральная часть атома,
вокруг которой по установленным кольцеобразным
орбитам движутся «планеты» - электроны. Принезна-
чительных смещениях электроны возбуждают электро-
магнитные волны. Но его работа, о которой Э. Резер-
Х. Нагаока (1865-1950) форд не знал, не получила дальнейшего развития.
 Но вскоре оказалось, что новые опытные факты опровергают модель Джозефа Томсона и, наоборот, свидетельствуют в пользу планетарной модели.
Но вскоре оказалось, что новые опытные факты опровергают модель Джозефа Томсона и, наоборот, свидетельствуют в пользу планетарной модели.
Эти факты были открыты выдающимся английским физиком Э. Резерфордом.
В первую очередь следует отметить открытие им ядерного строения атома.
Э. Резерфорд (1871-1937)
Ученик Джозефа Томсона Эрнест Резерфорд (Нобелевская премия по химии, 1908) врезультате знаменитых экспериментов по рассеянию золотой фольгой α-частиц «разделил» атом на маленькое положительно заряженное ядро и окружающие его электроны (рис. 10).
В 1908–1909 г.г. работавшие в университете Виктории (Манчестер, Англия) у Резерфорда Ханс Гейгер, который незадолго до этого сконструировал совместно с ним счетчик альфа-частиц, и ЭрнестМарсден установили, что при прохождении альфа-частиц сквозь тонкие пластинки из золотой фольги подавляющее их большинство пролетает навылет, но единичные частицы отклоняются на углы больше 90о, т.е. полностью отражаются.
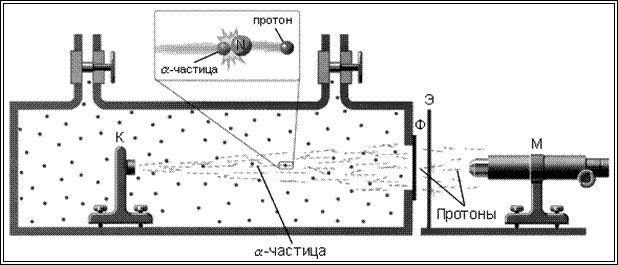
Рис. 10. Рассеяние альфа-частиц в опыте Э.Резерфорда
К – свинцовый контейнер с радиоактивным источником α-частиц,
Ф – золотая фольга, Э – экран, покрытый сульфидом цинка, М – микроскоп
 Следует, однако, добавить, что еще в 1908 г. француз-
Следует, однако, добавить, что еще в 1908 г. француз-
ский физик и математик Жюль Анри Пуанкаре писал в своей статье: «Все опыты над проводимостью газов… дают нам основание рассматривать атом, как состоящий из положительно заряженного центра, по массе равного приблизительно самому атому, причем вокруг этого цент-
ра вращаются, тяготея к нему, электроны». Но это был вывод теоретика, вывод аналитический и непроверенный.
 2015-02-04
2015-02-04 1257
1257
