Пример 1:
На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода, измеренного при (н.у.). Вычислить молярные массы металла и оксида. Чему равна относительная масса металла?
Решение:
По закону эквивалентов массы веществ m1 и m2, вступающих в реакцию, пропорциональны молярным массам их эквивалентов 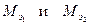
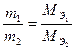 ; (1)
; (1)
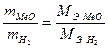 (2)
(2)
Если одно из веществ находится в газообразном состоянии, то как правило, его количество измеряется в объемных единицах (см3, л, м3).
Формулу (2) преобразуем относительно объема водорода:
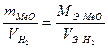
Находим молярную массу эквивалента металла:
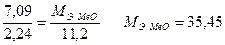
По закону эквивалентов:
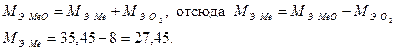
Относительную атомную массу металла определяем из соотношения:
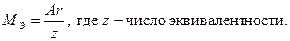
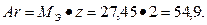
Пример 2:
Определить молярную массу эквивалента Fe2(SO4)3 в реакции ионного обмена: Fe2(SO4)3 + 6NaOH = 2 Fe(OH)3 + 3 Na2SO4.
Решение:
По стехиометрии реакции Z частицы Fe2(SO4)3 равно 6, т. к. при делении коэффициента перед Fe2(SO4)3 получается правильная дробь 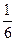 , знаменатель которой равен 6. Так как
, знаменатель которой равен 6. Так как 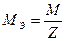 , то молярная масса эквивалента сульфата железа (Ш) в данной реакции может быть вычислена по формуле
, то молярная масса эквивалента сульфата железа (Ш) в данной реакции может быть вычислена по формуле
МЭ(Fe2(S04)3) = M(Fe2(SO4)3) /6 = 400/6 = 66,7 (г/моль).
 2015-01-07
2015-01-07 4635
4635
