Химическим эквивалентом (Э) называется реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна (равноценна) одному иону водорода в кислотно-основных и обменных реакциях, либо одному электрону в окислительно-восстановительных реакциях.
Реальные частицы - это атомы, ионы, молекулы и т.д., а условные частицы - это, например, 1/2 (H2SO4), 1/4(С), 1/3(Fe3+).
В общем случае эквивалент любого вещества X может быть записан в виде ЭХ =1/z(X), где z - число эквивалентности, или эквивалентное число, которое всегда > 1. Оно показывает, сколько эквивалентов содержится в одной формульной единице вещества.
Для данного вещества z находится по конкретной реакции. В окислительно-восстановительных процессах z определяется числом электронов, принятых или отданных одной формульной единицей вещества, например, в реакции:
Mg + 2HCl → MgCl2 + H2
Z(Mg)=2, т.к. магний в ходе окислительно-восстановительной реакции отдает 2 электрона, а ЭMg =½ (Mg). В обменных процессах Z определяется стехиометрией и равно знаменателю правильной дроби, которая получается при делении коэффициента перед веществом на самый большой коэффициент в реакции:
АI2O3 + 6HCI =2AICI3 +3H2O
Z (АI2O3) = 6, т.к. при делении коэффициента перед АI2O3 на самый большой коэффициент в реакции - 6, получается правильная дробь 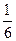 , знаменатель которой равен 6; Z(HCI) = 1, т.к. при делении коэффициента перед HCI на самый большой коэффициент в реакции - 6, получается 1.
, знаменатель которой равен 6; Z(HCI) = 1, т.к. при делении коэффициента перед HCI на самый большой коэффициент в реакции - 6, получается 1.
Когда речь не идет о конкретной реакции, при определении z для сложных веществ можно воспользоваться следующими правилами:
1) для оксидов z равно числу атомов элемента, умноженному на степень окисления элемента;
2) для кислот z равно основности кислоты;
3) для оснований z равно кислотности основания;
4) для солей z равно числу катионов металла, умноженному на заряд катиона.
Количество вещества эквивалента обозначается vЭ,единица измерения - моль. Один моль эквивалента вещества содержит 6,022-1023 эквивалентов.
Молярная масса эквивалента MЭ - это масса 1 моль эквивалентов вещества, измеряется в г/моль.
Связь между молярной массой эквивалента, количеством вещества эквивалента, массой и молярной массой вещества выражается соотношениями:


Экспериментальное определение молярной массы химического эквивалента цинка в данной работе основано на законе эквивалентов:
Вещества реагируют друг с другом в равных количествах эквивалентов  .
.
Из закона эквивалентов следует, что массы реагирующих друг с другом веществ, а также массы продуктов реакции относятся друг к другу как молярные массы их эквивалентов:
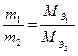
Если вещество находится в газообразном состоянии то для него справедливы соотношения: 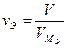 ;
; 
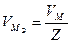 ; где
; где 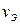 – количество вещества эквивалента; V – объем газообразного вещества в данных условиях;
– количество вещества эквивалента; V – объем газообразного вещества в данных условиях; 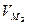 – молярный объем эквивалента вещества в тех же условиях; VM – молярный объем вещества; Z – число эквивалентности.
– молярный объем эквивалента вещества в тех же условиях; VM – молярный объем вещества; Z – число эквивалентности.
 2015-01-07
2015-01-07 1309
1309








