1. Подготовить термометр Бекмана, так как это было описано в предыдущей работе.
2. Собрать прибор по рис. 1, предварительно заполнив толстостенный стакан охладительной смесью, состоящей из трех частей снега (толченого льда) и одной части поваренной соли. Температура смеси должна быть -5 -7 0С. Ее можно регулировать при помощи изменения соотношения снега (льда) и соли.
3.Отмерить 10 мл Н2О и влить через боковой отросток в пробирку 1 (масса растворителя Н2О 10 г).
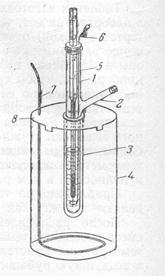 4. Все время, перемешивая воду мешалкой, определить по температуре замерзания воды нулевую точку термометра. Нужно иметь в виду, что жидкость часто переохлаждается. Поэтому температурой замерзания воды следует считать температуру, которая устанавливается в момент замерзания после некоторого скачка вверх (
4. Все время, перемешивая воду мешалкой, определить по температуре замерзания воды нулевую точку термометра. Нужно иметь в виду, что жидкость часто переохлаждается. Поэтому температурой замерзания воды следует считать температуру, которая устанавливается в момент замерзания после некоторого скачка вверх ( ).
).
 5. Вынуть пробирку 1 из прибора, растопить лед и еще раз определить температуру замерзания воды (
5. Вынуть пробирку 1 из прибора, растопить лед и еще раз определить температуру замерзания воды ( ).
).
6. Взвесить на аналитических весах бюкс, в котором находится 0,3-0,5 г хлорида калия ( ).
).
7. Всыпать 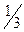 взвешенного хлорида калия через боковой отросток в пробирку 1 и растворить его в находящейся там дистиллированной воде.
взвешенного хлорида калия через боковой отросток в пробирку 1 и растворить его в находящейся там дистиллированной воде.
8. Взвесить бюкс с остатком хлорида калия (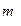 ).
).
9. По разнице масс (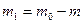 ) вычислить массу растворенного хлорида калия.
) вычислить массу растворенного хлорида калия.
10. Определить температуру замерзания раствора хлорида калия так, как это было описано в пункте 4. Измерения повторить еще раз (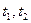 ).
).
11. Рассчитать кажущуюся степень электролитической диссоциации по формуле (4).
12. Результаты опыта представить в виде таблицы:
| Масса растворителя, г m2 | Температура замерзания, 0С | 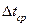
| Масса бюкса, г | Масса КСI, г | Кажущаяся степень электролитической диссоциации, α | ||||||
Воды, 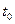
| Раствора, 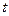
| 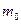
| 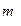
| 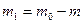
| |||||||
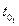
| 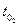
| 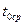
| 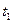
| 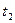
| 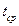
| ||||||
13. Выводы.
 2015-01-07
2015-01-07 446
446








