Согласно этому принципу электроны заполняют орбитали в порядке повышения уровня энергии орбиталей. В первую очередь заполняются орбитали с наименьшей энергий, т.к. на такой орбитали состояние электрона наиболее стабильно. Возрастание энергии по энергетическим подуровням происходит примерно в следующем порядке:
1s ˂ 2s ˂ 2p ˂ 3s ˂ 3p ˂ 4s ˂ 3d ˂ 4p ˂ 5s ˂ 4d ˂ 5p ˂ 6s ˂ 4f ≈
≈ 5d ˂ 6p ˂ 7s ˂ 5f ≈ 6d ˂ 7p.
При заполнении электронных уровней необходимо учитывать правило В.М. Клечковского: последовательное заполнение электронами подуровней происходит в порядке увеличения суммы главного и побочного квантовых чисел 
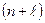 . При одинаковом значении этой суммы для нескольких подуровней, в первую очередь заполняется тот, главное квантовое число которого меньше.
. При одинаковом значении этой суммы для нескольких подуровней, в первую очередь заполняется тот, главное квантовое число которого меньше.
Химическая кинетика и равновесие
 2015-01-07
2015-01-07 1526
1526








