| Электрод | Е0, В | Электрод | Е0, В |
| Li+/ Li | -3.045 | Cd2+/Cd | -0.403 |
| Rb+/ Rb | -2.925 | Co2+/Co | -0.277 |
| K+/K | -2.924 | Ni2+/Ni | -0.25 |
| Cs+/Cs | -2.923 | Sn2+/ Sn | -0.136 |
| Ba2+/Ba | -2.90 | Pb2+/Pb | -0.127 |
| Ca2+/Ca | -2.87 | Fe3+/Fe | -0.037 |
| |Na+/Na | -2.714 | 2H+/H2 | -0.000 |
| Mg2+/Mg | -2.37 | Sb3+/Sb | +0.20 |
| Al3+/Al | -1.70 | Bi3+/Вi | +0.215 |
| Ti2+/Ti | -1.603 | Cu2+/Сu | +0.34 |
| Zr4+/Zr | -1.58 | Cu+/Cu | +0.52 |
| Mn4+/Mn | -1.18 | Hg2+2/2Hg | +0.79 |
| V2+/V | -1.18 | Ag+/Ag | + 0.80 |
| Cr2+/Cr | -0.913 | Hg2+/Hg | +0.85 |
| Zn2+/Zn | -0.763 | Pt2+/Pt | +1.19 |
| Cr3+/Cr | -0.74 | Au3+/Au | +1.50 |
| Fe2+/Fe | -0.44 | Au+/Au | +1.70 |
Пример 2. Вычисление концентрации ионов металла в зависимости от электродного потенциала
Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен -2.41 В. Вычислите концентрацию ионов магния (в моль/л).
Решение. Подобные задачи также решаются на основании уравнения Нернста (см. пример 1):
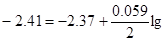 с,-0,04=0,0295lg c?
с,-0,04=0,0295lg c?
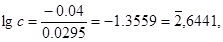
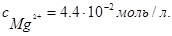
Пример З. Составление схемы гальванического элемента
Составьте схему- гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Решение. Схема данного гальванического элемента
(-) Mg | Mg2+ || Zn2+ | Zn (+)
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg°-2e- = Mg2+ (1)
Цинк, потенциал которого -0,763 В, — катод, т.е. электрод, на котором протекает восстановительный процесс:
Zn2+ + 2е~ = Zn° (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg+ Zn2+ = Mg2+ + Zn
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе 1моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
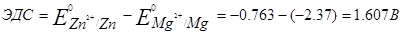
 2015-01-13
2015-01-13 518
518







