Пример 1. Вычисление массы вещества, выделяющегося при электролизе
Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч. При силе тока 4А?
Решение. Согласно законам Фарадея m = ЭIt /96500, (1)
где т — масса вещества, окисленного или восстановленного на электроде; Э – молярная масса эквивалента вещества; I – сила тока, A; t – продолжительность электролиза, с.
Молярная масса эквивалентов меди в CuSO4 равна 63,54: 2 = =31,77 г/моль. Подставив в формулу (1) значения Э = 31,77, I = 4 А, t= 60 ∙ 60 = 3600 с, получим
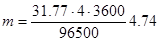
Пример 2. Определение молярной массы эквивалента металла по количеству электричества, прошедшего через электролит
Вычислите молярную массу эквивалента металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделяется 11,742 г металла.
Решение. Подставляя в формулу (1) числовые значения, получаем
Э = 11,742 ∙ 96500/3880 = 29,35 г/моль,
где m = 11,742 г; It = Q = 3880 Кл.
Пример 3. Определение силы тока по объему выделившегося при электролизе водорода
|
|
|
Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода (н.у.)?
Решение. Из формулы (1) I = m 96500/Эt
Так как дан объем водорода, то отношение т/Э заменяем отношением VH; /VЭ(Н  ), где V H
), где V H  — объем водорода, л.; VЭ(Н
— объем водорода, л.; VЭ(Н  ) объем эквивалентной массы водорода, л. Тогда I = VH
) объем эквивалентной массы водорода, л. Тогда I = VH 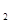 96500/ VЭ(Н
96500/ VЭ(Н 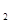 ).
).
Объем эквивалентной массы водорода при н.у. равен половине молярного объема 22,4/2 = 11,2 л. Подставив в приведенную формулу значения VН 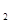 = 1,4л, VЭ(Н
= 1,4л, VЭ(Н 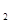 ) = 11,2 л, t = 6025 (1 ч 40 мин 25 с=6025с), находим
) = 11,2 л, t = 6025 (1 ч 40 мин 25 с=6025с), находим
I = 1,4∙96,500/(11.2∙6025) = 2А
Пример 4. Определение массы веществ, образовавшихся у электродов при электролизе солей щелочных металлов и кислородосодержащих кислот
Какая масса гидроксида калия образовалась у катода при электролизе раствора K2SO4, если на аноде выделилось 11,2 л кислорода (н.у.)?
Решение. Объем эквивалентной массы кислорода (н.у.) 22,4/4 = = 5,6 л. Следовательно, 11,2 л содержат две молярные массы эквивалента кислорода. Столько же эквивалентных масс КОН образовалось у катода, или 56,11 ∙ 2 = 112,22 г (56,11 г/моль — молярная и эквивалентная масса КОН).
9.3.Коррозия металлов
Коррозия — это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой.
При электрохимической коррозии на поверхности металлаодновременно протекают два процесса: анодный — окисление металла
Ме°-пе=Меп+ и катодный — восстановление ионов водорода
2Н+ + 2е = Н2
или молекул кислорода, растворенного в воде,
О2 + 2Н2О + 4е- = 4ОН-
Ионы или молекулы, которые восстанавливаются на катоде, называют деполяризаторами. При атмосферной коррозии — коррозии во влажном воздухе при комнатной температуре — деполяризатором является кислород.
|
|
|
Пример 1. Определение продуктов коррозии и составление электродных процессов
Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. Цинк имеет более отрицательный потенциал (-0,763 В), чем кадмий (-0,403 В), поэтому он является анодом, а кадмий катодом.
Анодный процесс: Zn°-2e-=Zn2+
катодный процесс:
в кислой среде 2Н+ + 2е- = Н2
в нейтральной среде ½ О2 + Н2О + 2е- = 2ОН-
Так как ионы Zn2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(OH)2.
 2015-01-13
2015-01-13 3618
3618
