1.Найдите степень диссоциации сульфата меди по значению изотермического коэффициента раствора, равного 1.7.
2.Вычислите степень диссоциации азотистой кислоты в ее 0.01 М растворе и концентрацию ионов водорода в растворе, если Кд - 4.6 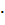 10-4.
10-4.
3. Определите степень диссоциации и концентрацию ионов [ 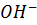 ] в 0.1 M растворе
] в 0.1 M растворе 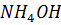 ? если Кд - 2
? если Кд - 2 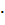 10-3.
10-3.
4. Вычислите степень диссоциации а и [ 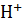 | в 0.1 М растворе хлорноватистой кислоты, если Кд = 5
| в 0.1 М растворе хлорноватистой кислоты, если Кд = 5 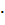 10-8.
10-8.
5. Давление водяного пара над раствором 66.6 г 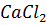 в 90 г
в 90 г 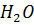 при 90 °С равно 56690 Па. Чему равен изотонический коэффициент, если давление паров воды при той же температуре равно 70101 Па.
при 90 °С равно 56690 Па. Чему равен изотонический коэффициент, если давление паров воды при той же температуре равно 70101 Па.
6. Изотонический коэффициент раствора 178.5 г KBr в 900 г 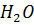 равен 1.7. Определите давление водяного пара над этим раствором при 50
равен 1.7. Определите давление водяного пара над этим раствором при 50 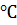 , если давление паров воды при 50 °С равно 12334 Па.
, если давление паров воды при 50 °С равно 12334 Па.
7. Раствор, содержащий 16.05 г 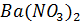 в 500 г воды, кипит при 100.122°С. Рассчитайте изотонический коэффициент этого раствора.
в 500 г воды, кипит при 100.122°С. Рассчитайте изотонический коэффициент этого раствора.
8. Изотонический коэффициент водного раствора соляной кислоты равен 1.66 (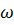 = 0.068), Вычислите температуру замерзания этого раствора.
= 0.068), Вычислите температуру замерзания этого раствора.
9. Изотонический коэффициент 1 Н 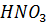 равен 1.03. Сколько растворенных частиц содержится в 10-3 л этого раствора?
равен 1.03. Сколько растворенных частиц содержится в 10-3 л этого раствора?
10. Определите осмотическое давление 0.01 Н 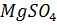 при 18°С, если кажущаяся степень диссоциации этого электролита равна 66%.
при 18°С, если кажущаяся степень диссоциации этого электролита равна 66%.
11. Определите давление пара водяного раствора гидроксида калия (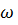 = =0.55) при 50°С. Давление пара воды при этой температуре равно 12.334 Па. Кажущаяся степень диссоциации гидроксида калия в этом растворе равна 87%.
= =0.55) при 50°С. Давление пара воды при этой температуре равно 12.334 Па. Кажущаяся степень диссоциации гидроксида калия в этом растворе равна 87%.
12. Вычислите кажущуюся степень диссоциации NaCI в 0.25 H растворе, если этот раствор изотоничен с 0.44 М раствором глюкозы 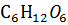 при 18°С.
при 18°С.
13. Кажущаяся степень диссоциации 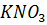 в растворе, содержащем 4.55 г
в растворе, содержащем 4.55 г 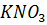 и 50 г воды, равна 70%. Во сколько раз повышение температуры кипения этого раствора больше повышения температуры кипения эквивалентного раствора неэлектролита?
и 50 г воды, равна 70%. Во сколько раз повышение температуры кипения этого раствора больше повышения температуры кипения эквивалентного раствора неэлектролита?
14. Раствор, содержащий 14.62 г NaCI в 500 г воды, замерзает при -1.67°С. Вычислите кажущуюся степень диссоциации этого электролита.
15. Чему равен изотонический коэффициент раствора 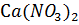 , если для него молярная концентрация эквивалента 0.05 моль
, если для него молярная концентрация эквивалента 0.05 моль 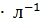 , а осмотическое давление при 0°С составляет 1.474
, а осмотическое давление при 0°С составляет 1.474 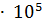 ? Найдите
? Найдите 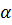 соли по этим данным.
соли по этим данным.
16. Определите кажущуюся степень диссоциации иодида натрия в растворе, содержащем 0.506 г NaJ на 22.48 г этилового спирта. Раствор такой концентрации кипит при 78.464°С. Чистый этиловый спирт кипит при 78.300°С. Эбуллиоскопическая постоянная спирта равна 1.19°С.
17. Раствор, в котором массовое отношение цианида калия и воды равно 3:500, замерзает при -0.32 °С, а экспериментально найденная 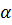 соли составляет 84%. Найдите молярную массу KCN.
соли составляет 84%. Найдите молярную массу KCN.
18. При какой температуре должен замерзать раствор, в котором m( ), равная 0.412 г, приходится на 50 мл воды, если считать, что для соли
), равная 0.412 г, приходится на 50 мл воды, если считать, что для соли 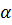 = 0 или
= 0 или 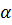 = 1.
= 1.
19. Раствор, содержащий нитрат цинка количеством вещества 0.0065 моль и воду массой 100 г, замерзает при -0.32 °С. Какое значение 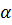 определяют эти данные?
определяют эти данные?
20. Найдите значение 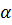
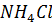 в растворе, для приготовления которого соль была взята массой 1.07 г и растворена в растворе объемом 200 мл, а от tкип полученного раствора оказалась равной 100.09 °С.
в растворе, для приготовления которого соль была взята массой 1.07 г и растворена в растворе объемом 200 мл, а от tкип полученного раствора оказалась равной 100.09 °С.
21. При растворении гидроксида натрия массой 12 г в воде массой 100 г температура кипения повысилась на 2.65°С. Какая степень диссоциации NaOH соответствует этим данным?
22. Давление пара раствора, в котором количество вещества сульфата натрия и масса воды находятся в соотношении 0.05 моль на 450 г, равно 1.0072 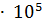 Па при 100 °С. Какое значение
Па при 100 °С. Какое значение 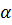 определяется по этим данным?
определяется по этим данным?
23. Какое осмотическое значение при 27 °С будет иметь раствор, содержащий 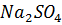 массой 2.26 г в растворе объемом 150 мл, если экспериментально найденная α соли равна 80%.
массой 2.26 г в растворе объемом 150 мл, если экспериментально найденная α соли равна 80%.
24. Экспериментальное значение степени диссоциации 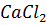 и
и 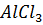 приблизительно одинаково в растворах концентрации 0.1 моль
приблизительно одинаково в растворах концентрации 0.1 моль 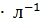 . Какой раствор будет замерзать при более высокой температуре?
. Какой раствор будет замерзать при более высокой температуре?
25. Раствор, содержащий 0.85 г хлорида цинка в 125 г воды, кристаллизируется при - 0.23° С. Определите кажущуюся степень диссоциации 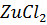 .
.
5. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
[1]. Вычислите pH и рОН 0.01 М раствора HCI.
2. Вычислите концентрацию ионов водорода в растворе, pH которого 12.05.
3. Вычислите pH 0.1 Н раствора HCI.
4. Вычислите молярную концентрацию раствора муравьиной кислоты (pH=3, Кд=2.1 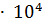 ).
).
5. Вычислите pH 0.01 %-ного раствора HCI (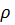 = 1 г
= 1 г 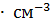 ,
, 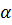 = 1).
= 1).
6. Вычислите pH 3.12 %-ного раствора HCI (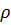 = 1.015 г
= 1.015 г 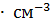 ).
).
7. Вычислите pH следующих растворов КОН (степень диссоциации принять равной единице).
а) 0.01 М; б) 0.005 М.
8. Вычислите pH и рОН 1 М раствора NaOH (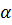 = 72.6 %).
= 72.6 %).
9. Какова молярная концентрация раствора соляной кислоты, если pH ее 1.6.
10. Вычислите pH для 0.01 М раствора цианистоводородной кислоты, если Kд(HCN)=7,2 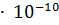 .
.
[1]1. Определите, в каком из растворов больше величина pH: в 0.01 М растворе соляной кислоты или в 0.1 М растворе цианистоводородной кислоты HCN.
12. В каком случае pH имеет большую величину: в 0.0001 М растворе 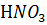 или в 0.01 М растворе
или в 0.01 М растворе 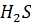 .
.
13. Вычислите pH 4% - ного раствора борной кислоты, считая 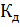 (
(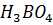 ) = = 5.7
) = = 5.7 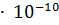 .
.
14. Какая масса НСООН содержится в 0.3 л раствора этой кислоты, имеющей pH 6.04? Кд = 1.77 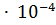 .
.
15. Чему равна константа диссоциации кислоты, если pH 0.08 Н раствора кислоты равен 2.4.
16. Определите pH раствора, в 3 л которого содержится 0.81 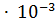 моль ионов
моль ионов 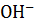 .
.
17. Какое значение имеет pH для растворов 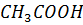 и
и 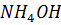 , если { их концентрация равна 0.1 моль
, если { их концентрация равна 0.1 моль 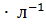 и
и 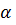 = 1.3 %.
= 1.3 %.
18. Определите концентрацию ионов 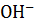 в 0.01 М
в 0.01 М 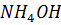 . Рассчитайте pH этого раствора при 295 К.
. Рассчитайте pH этого раствора при 295 К.
19. В 200 мл раствора гидроксида натрия содержится 0.2 г NaOH. Вычислите pH этого раствора.
20. Определите активности ионов 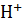 и
и 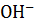 в некотором растворе, если его pH 4.7.
в некотором растворе, если его pH 4.7.
21. Рассчитайте активности ионов 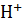 и
и 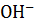 в некотором растворе, если его pH 13.23.
в некотором растворе, если его pH 13.23.
22. Рассчитайте pH 0.01 М 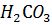 (диссоциацией по второй ступени можно пренебречь).
(диссоциацией по второй ступени можно пренебречь).
23. Рассчитайте pH 0.01 М 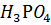 (диссоциацией по второй и третьей ступени можно пренебречь).
(диссоциацией по второй и третьей ступени можно пренебречь).
24. Какое количество гидроксида натрия растворено в 200 мл раствора NaOH, если pH этого раствора 12?
25. Вычислите pH раствора азотной кислоты (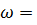 0.0005). Плотность раствора и степень диссоциации
0.0005). Плотность раствора и степень диссоциации 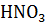 считать равным единице.
считать равным единице.
 2015-01-13
2015-01-13 2649
2649








