Все газы, в том числе природный газ, подчиняются определенным законам. Но следует отметить, что эти законы в строгой форме справедливы только для идеальных газов. Реальные же газы имеют отклонение от законов для идеальных газов. Однако эти отклонения заметны только при давлениях более 0,5 МПа. Так как в городских системах газоснабжения, как правило, используют давления, не превышающие указанных пределов, то при проектировании и эксплуатации газовых сетей можно без каких-либо погрешностей пользоваться законами идеальных газов.
Закон Бойля – Мариотта определяет зависимость между давлением и объемом при постоянной температуре:
P 0 V 0 = P 1 V 1 = PV, (1.1)
PV - const,
где Р о, Р 1, Р – абсолютные давления; V o, V 1 , V – объемы газа при тех же давлениях.
Отсюда, если объем V oгаза, имеющего температуру Т ои абсолютное давление Р о, увеличить при неизменной температуре Т о до объема V, то абсолютное давление этого газа изменится обратно пропорционально его объему:
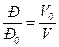 . (1.2)
. (1.2)
Этот закон, как мы увидим далее, обязательно учитывается при расчете газопроводов среднего, и высокого давления, распределительных газовых сетей, а также при подсчете количества газа, поданного по трубопроводам или находящегося в каких-либо емкостях или газгольдерах.
Закон Гей-Люссака определяет зависимость объема газа при постоянном давлении от температуры. Он выражается следующей формулой:
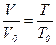 , (1.3)
, (1.3)
т.е. при постоянном давлении объем газа пропорционален абсолютной температуре.
Уравнение закона Гей-Люссака можно также представить в виде:
V = V 0(1 + α t), (1.4)
где V o– объем газа при температуре газа, равной 0 °С; t - температура газа, °С; α – тепловой коэффициент расширения:
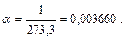
Изменение давления газа при постоянном объеме в зависимости от температуры (закон Шарля) описывается анологичным выражением:
P = P 0(1+α t), (1.5)
где Р о– давление газа при 0 °С.
Общее уравнение состояния газов связывает три основные параметры состояния газа:
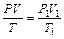 или
или 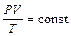 (1.6)
(1.6)
Если это уравнение отнести к одному киломолю газа, тоуравнение состояния примет следующий вид:
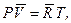 (1.7)
(1.7)
где Т – абсолютная температура газа; 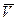 – объем киломоля газа;
– объем киломоля газа; 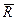 – универсальная газовая постоянная, имеющая одно и тоже численное значение для всех газов.
– универсальная газовая постоянная, имеющая одно и тоже численное значение для всех газов.
Поскольку, в соответствии с законом Авогадро, при нормальных физических условиях (t=0 °С, Р 0=101,3 кПа) объемы 1 киломоля различных идеальных газов одинаковы и равны 22,4 нм3/кмоль, численные значения универсальной газовой постоянной равно
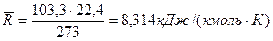 .
.
Для любого однородного газа удельная характеристическая газовая постоянная R yд, Дж/(кг·К),равна универсальной газовой постоянной 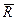 , деленной на молекулярную массу этого газа М:
, деленной на молекулярную массу этого газа М:
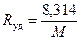 . (1.8)
. (1.8)
 2015-01-21
2015-01-21 967
967








