Для металлических покрытий используют различные металлы, такие как цинк, никель, хром, медь, серебро, олово, золото и др. К преимуществам металлических покрытий относятся возможность создания тонких прочных покрытий с хорошей адгезией покрытия к металлу, сходные коэффициенты температурного расширения металлов, пластичность и т.д.
Основное защитное действие металлических покрытий заключается в их непроницаемости для воды, а следовательно, в предотвращении образования гальванических элементов.
Все металлические покрытия по возможностям дальнейшей защиты металла после их частичного разрушения подразделяют на катодные и анодные покрытия.
Катодное покрытие - это покрытие из металла, потенциал которого имеет большее значение, чем потенциал защищаемого металла. Катодными покрытиями, например, для железа являются покрытия из олова (Sn), никеля (Ni), меди (Сu), серебра (Ag), свинца (Рb).
Рассмотрим в качестве примера белую жесть (лужёное железо, т.е. железо, покрытое оловом) (рис.15)
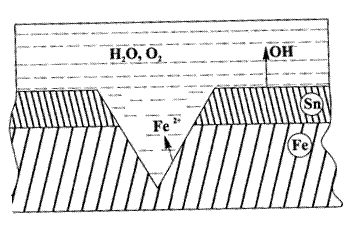
Рисунок 15 - Коррозия лужёного железа в воде, содержащей растворённый кислород
При повреждении покрытия и при наличии электролита возникает гальванический элемент, в котором железо (Е°Fe/Fe2+= - 0,44 В) будет выполнять функцию анода, а олово (Е° Sn/Sn2+ = - 0,14 В) будет катодом.
Электродные процессы при коррозии в нейтральной среде
Анод: Fe│Fe° - 2 ё → Fe2+
Катод:Sn│О2 +2Н2О + 4 ё → 4(ОН) -
Разрушается, окисляясь, железо. Следовательно, катодное покрытие может защищать металл от коррозии только при отсутствии повреждений. В отсутствие повреждений и при достаточной толщине, катодные покрытия являются очень долговечными.
Анодное покрытие - это покрытие металлом, потенциал которого имеет меньшее значение, чем потенциал защищаемого металла. Поэтому в случае повреждения покрытие станет функционировать как анод (поэтому и называется анодным) и разрушаться. Защищаемый металл будет катодом, на его поверхности происходит процесс восстановления, характер которого зависит от состава среды.
Рассмотрим коррозию оцинкованного железа в кислой среде (рис.16). При нарушении целостности такого покрытия окисляется цинк (Е°Zn/ Zn2+ = - 0,76 В), а на железе (Е°Fe/Fe2+ = - 0,44 В) протекает процесс восстановления ионов водорода.
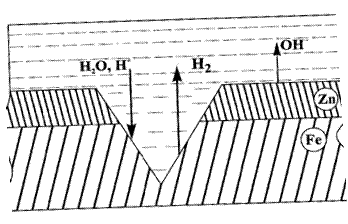
Рисунок 16 - Коррозия оцинкованного железа в кислой среде
Запишем процессы на аноде и на катоде:
Анод: Zn│Zn° - 2 ё → Zn2+
Катод: Fe│2Н++ 2ё → Н2
Таким образом, даже после частичного нарушения анодные покрытия продолжают защищать металл от коррозии. Только после разрушения значительных площадей покрытия начнётся коррозия защищаемого металла. Такие покрытия более эффективны, чем катодные или лакокрасочные, но иногда (при малой толщине покрытия) бывают недолговечными.
 2015-01-21
2015-01-21 6236
6236
