Суть этих методов заключается в том, чтобы при возможном возникновении гальванических элементов защищаемый металл был заведомо катодом, так как разрушается, окисляясь, всегда металл - анод. Для создания подобных гальванических элементов используют более активный металл либо внешний источник постоянного тока.
Использование более активных металлов
К одному из вариантов этой защиты можно отнести рассмотренные выше «анодные» металлические покрытия после их частичного нарушения.
Если более активный металл вводят в объём защищаемого металла, образуются устойчивые к коррозии сплавы. В частности, устойчивыми к коррозии сталями являются хромистые стали. При содержании хрома более 20% они обладают высокой стойкостью против всех видов коррозии, их часто называют нержавеющими. Хром имеет меньший потенциал, чем железо, поэтому железо в возможно образующихся на поверхности микрогальванических элементах будет катодом.
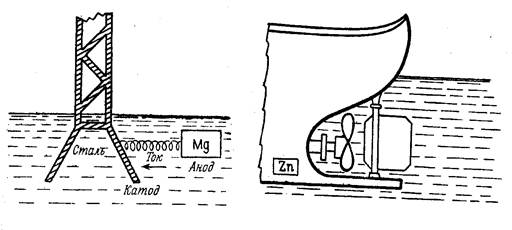
Активные металлы (имеющие меньшие значения потенциалов) или содержащие их сплавы используют в качестве протекторов. Металл-протектор присоединяют к поверхности защищаемой металлической конструкции. Обычно используют несколько протекторов, присоединяемых к одной конструкции. Образуются гальванические элементы, в которых защищаемый металл является катодом, а протектор - анодом. Для защиты стальных изделий в качестве протекторов используют цинк или сплавы на основе магния (рис. 17).
|
|
|
а б
а) - опора ЛЭП; б) - корпус корабля
Рисунок 17 - Схема протекторной защиты
Рассмотрим защиту стальной конструкции с помощью магниевых протекторов в воде с рН = 7. Магний является анодом (Е° Mg/Mg 2+ = -2,38 В,
Е°Fe/ Fe2+= -0,44В), и разрушается, а сталь является катодом, и на её поверхности происходит восстановление кислорода. Процесс восстановления не затрагивает и не изменяет металл катода, поэтому до тех пор, пока протекторы полностью не разрушатся, коррозия на поверхности стальной конструкции происходить не будет.
Анод: Mg│Fe° - 2 ё → Fe2+
Катод: Fe│О2 +2Н2О + 4 ё → 4(ОН) -
Протекторную защиту обычно применяют как дополнительный способ защиты в сочетании с различными гидроизолирующими покрытиями.
Электрозащита от коррозии
Сущность электрозащиты (защита наложенным постоянным током) состоит в том, что защищаемая металлическая конструкция подключается к отрицательному полюсу внешнего источника постоянного тока (выпрямителя, генератора), поэтому она будет катодом, а анодом служит вспомогательный электрод, обычно сталь, чугун (или металл), который присоединяется к положительному полюсу источника тока (рис. 18).
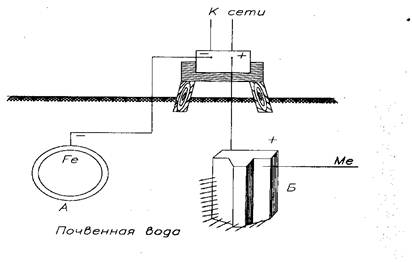
А) - защищаемый стальной трубопровод (катод);
|
|
|
Б) - вспомогательный электрод (анод)
Рисунок 18 - Схема электрозащиты
Электрозащиту чаще всего используют для массивных стальных конструкций, находящихся в воде или в почве, обычно в комбинации с изолирующими покрытиями. Преимущества электрозащиты заключаются в легкости регулирования подаваемого тока и поддержания необходимого за-
щитного потенциала, а также в возможности применения в качестве анодов дешёвых чёрных металлов или металлолома.
При катодной электрозащите на поверхности защищаемого металла (катод) в зависимости от значения рН и состава среды происходит восстановление ионов водорода или молекул кислорода, а вспомогательный металл (анод) разрушается.
Рассмотрим реакции при электрозащите стального трубопровода, находящегося в нейтральной среде (металл вспомогательного электрода обозначен символом Me).
Анод: Me│ Me0 - 2 ё →Ме2+
Катод: Fe│О2 +2Н2О + 4 ё → 4(ОН) -
 2015-01-21
2015-01-21 7752
7752
