Одним из наиболее часто используемых растворителей является вода, поэтому при различных расчетах используется ионное произведение воды.
Вода является очень слабым электролитом, но тем не менее ее молекулы также диссоциируют на ионы. Рассмотрим обратимую реакцию (реакция автопротолиза воды):
НОН «Н+ + ОН- или НОН + НОН = Н3О+ + ОН-
Н3О+ - ион гидроксония.
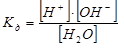 или
или 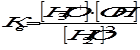 ; Кд = 1,86∙10-16.
; Кд = 1,86∙10-16.
Найдем ионное произведение воды.
[Н+][ОН-]= KW= Kд[НОН]; [HOH] = 1000/18 =55,5 моль/л.
[Н+][ОН-]= 1,86∙10-16 ∙55,5=10-14.
[Н+][ОН-]= 10-14
lg[H+] + lg[ОН-] = -14
-lg[H+] - lg[ОН-] = 14
Отрицательный логарифм некоторой величины М в химии принято обозначать рМ, где М – концентрация тех или иных ионов без указания их заряда, некая константа и т. д.
рН + рОН = 14.
В чистой воде, не содержащей растворенных веществ, [H+] = [ОН-].
[Н+] = [ОН-] = 10-7; [H+]2 = 10-14; [H+] = 10-7 и рН = 7.
рН – называют «водородным показателем». Зная рН раствора, легко найти его рОН и наоборот.
Тогда. Следовательно в водных растворах для нейтральной среды рН = 7. Тогда шкала рН в водных средах имеет вид
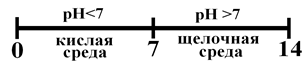
Рис. Шкала рН в водных растворах.
Это не значит, что рН кислых растворов не может быть меньше нуля, а щелочных – больше 14. Возможно и то, и другое. В сильнокислых средах рН < 0, в щелочных – рН > 14.
Если растворитель – этиловый спирт то
2 С2Н5ОН «С2Н5ОН2+ + С2Н5О-
этаксоний-ион этаксил-ион
Кд = 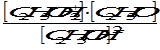 .
.
Ионное произведение сольвата [С2Н5ОН2+][С2Н5О-] = 10-19.
[С2Н5ОН2+] = [С2Н5О-] = 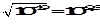
0______ _____9,5____ ______19.
Если в качестве растворителя используется аммиак, то
2 NH3«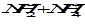 .
.
KS = 10-33
0______ _____16,5____ ______33.
 2015-01-21
2015-01-21 1517
1517








