Основная статья: Теорема Карно (термодинамика)
Из последнего выражения следует, что КПД тепловой машины, работающей по циклу Карно, зависит только от температур нагревателя и холодильника, но не зависит ни от устройства машины, ни от вида или свойств её рабочего тела. Этот результат составляет содержание первой теоремы Карно [6]. Кроме того, из него следует, что КПД может составлять 100 % только в том случае, если температура холодильника равна абсолютному нулю. Это невозможно, но не из-за недостижимости абсолютного нуля (этот вопрос решается только третьим началом термодинамики, учитывать которое здесь нет необходимости), а из-за того, что такой цикл или нельзя замкнуть, или он вырождается в совокупность двух совпадающих адиабат и изотерм.
Поэтому максимальный КПД любой тепловой машины не может превосходить КПД тепловой машины Карно, работающей при тех же температурах нагревателя и холодильника. Это утверждение называется второй теоремой Карно[5]. Оно даёт верхний предел КПД любой тепловой машины и позволяет оценить отклонение реального КПД от максимального, то есть потери энергии вследствие неидеальности тепловых процессов.
Неравенство Клаузиуса (1854): Количество теплоты, полученное системой при любом круговом процессе, делённое на абсолютную температуру, при которой оно было получено (приведённое количество теплоты), неположительно.
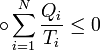
Подведённое количество теплоты, квазистатически полученное системой, не зависит от пути перехода (определяется лишь начальным и конечным состояниями системы) - для квазистатических процессов неравенство Клаузиуса обращается в равенство [1].

Энтропия системы — функция её состояния, определённая с точностью до произвольной постоянной. Разность энтропий в двух равновесных состояниях 1 и 2 по определению равна приведённому количеству теплоты, которое надо сообщить системе, чтобы перевести её из состояния 1 в состояние 2 по любому квазистатическому пути.

Из неравенства Клаузиуса и определения энтропии непосредственно следует эквивалентный второму началу термодинамики
Закон возрастания энтропии. Энтропия адиабатически изолированной системы либо возрастает, либо остаётся постоянной.
Мы знаем, что 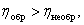 т.е.
т.е.
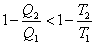 . . | (6.4.4) |
Отсюда 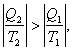 тогда
тогда 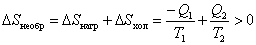 .
.
Таким образом,
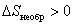 или или | 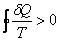 | (6.4.5) |
Это выражение называют неравенством Клаузиуса: при любом необратимом процессе в замкнутой системе энтропия возрастает (dS > 0).
ОСНОВНОЕ УРАВНЕНИЕ ТЕРМОДИНАМИКИ ΔU = ∑(P + ΔP)dx - ∑(X + ΔX)dx
30. Свобо́дная эне́ргия Гельмго́льца (или просто свобо́дная эне́ргия) — термодинамический потенциал, убыль которого в квазистатическомизотермическом процессе равна работе, совершённой системой над внешними телами. Свободная энергия Гельмгольца для системы с постоянным числом частиц определяется так:
· 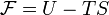 , где
, где 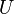 — внутренняя энергия,
— внутренняя энергия, 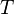 — абсолютная температура,
— абсолютная температура, 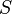 — энтропия.
— энтропия.
Отсюда дифференциал свободной энергии равен:
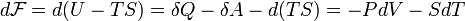 .
.
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении.
Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом E пот = pSx = pV
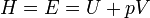
Понятие энтропии позволяет отличать в случае изолированных систем обратимые процессы (энтропия максимальна и постоянна) от необратимых процессов (энтропия возрастает)
В действительности второй закон термодинамики не имеет такого универсального характера, как первый закон термодинамики, поскольку само понятие необратимости является относительным. По Больцману самопроизвольные необратимые процессы являются проявлением того, что система стремится к переходу от менее вероятного неравновесного состояния к наиболее вероятному равновесному состоянию. Связывая такую трактовку вопроса с понятием энтропии, Больцман получил следующую формулу
 , (5.36)
, (5.36)
где Р –термодинамическая вероятность состояния системы,
k – постоянная Больцмана, т.е. универсальная газовая постоянная, отнесенная к одной молекуле
 Дж/град,
Дж/град,
где N – число Авогадро.
Тепловая смерть — конечное состояние любой замкнутой термодинамической системы, и Вселенной в частности. При этом никакого направленного обмена энергией наблюдаться не будет, так как все виды энергии перейдут в тепловую. Термодинамика рассматривает систему, находящуюся в состоянии тепловой смерти, как систему, в которой термодинамическая энтропия максимальна.
31. Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при приближении температуры кабсолютному нулю. Является одним из постулатов термодинамики, принимаемым на основе обобщения значительного количества экспериментальных данных. Третье начало термодинамики может быть сформулировано так:
«Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система».
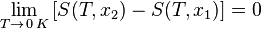
или

где 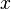 — любой термодинамический параметр.
— любой термодинамический параметр.
Третье начало термодинамики относится только к равновесным состояниям.
Закон Бо́йля — Марио́тта — один из основных газовых законов, открытый в 1662 году Робертом Бойлем и независимо переоткрытый Эдмом Мариоттом в 1676 году[1]. Описывает поведение газа в изотермическом процессе. Закон является следствием уравнения Клапейрона[2]. Утверждение закона Бойля — Мариотта состоит в следующем[3][4][5]:
При постоянных температуре и массе газа произведение давления газа на его объём постоянно.
В математической форме это утверждение записывается в виде формулы
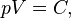
где 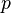 — давление газа;
— давление газа; 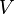 — объём газа, а
— объём газа, а  — постоянная в оговоренных условиях величина. В общем случае значение
— постоянная в оговоренных условиях величина. В общем случае значение  определяется химической природой, массой и температурой газа.
определяется химической природой, массой и температурой газа.
Закон Бойля — Мариотта утверждает, что давление газа в изотермическом процессе обратно пропорционально занимаемому газом объёму. Если учесть, что плотность газа[6]также обратно пропорциональна занимаемому им объёму, то мы придём к заключению:
При изотермическом процессе давление газа изменяется прямо пропорционально его плотности.
Отклонение поведения реальных газов от закона Бойля — Мариотта. Пунктир соответствует линии pV=C

Межмолекулярное взаимодействие — взаимодействие между молекулами и/или атомами, не приводящее к образованию ковалентных (химических) связей.
 2015-01-21
2015-01-21 4026
4026
