19 В основе МКТ строения вещества лежат три положения, каждое из которых доказано с помощью наблюдений и опытов (броуновское движение, диффузия и др.):
1. вещество состоит из частиц;
2. частицы хаотически движутся;
3. частицы взаимодействуют друг с другом.
Упрощенный вывод основного уравнения МКТ[править | править вики-текст]
Пусть имеется 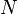 частиц массой
частиц массой 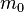 в некотором кубическом сосуде.
в некотором кубическом сосуде.
Так как молекулы движутся хаотически, то события, состоящие в движении в одном из шести независимых направлений пространства, совпадающих с осями декартовой системы координат, равновероятны.
Поэтому, в каждом из этих направлении движется 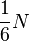 частиц.
частиц.
Пусть все частицы обладают одинаковой скоростью 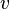 .
.
Каждая из частиц, сталкивающихся со стенкой, передаёт ей импульс 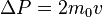 .
.
Если площадь стенки 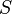 , а концентрация -
, а концентрация - 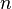 , то количество частиц, сталкивающихся со стенкой за время
, то количество частиц, сталкивающихся со стенкой за время 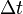 равно
равно 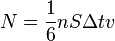 .
.
Так как 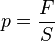 , а
, а 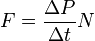 - суммарная сила взаимодействия частиц со стенкой, то подставив соответствующие значения получим
- суммарная сила взаимодействия частиц со стенкой, то подставив соответствующие значения получим 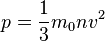 ,
,
так как 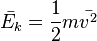 , то
, то 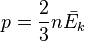
1. Для данной массы газа при постоянной температуре 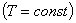 давление газа изменяется обратно пропорционально объему (закон Бойля-Мариотта): давление газа изменяется обратно пропорционально объему (закон Бойля-Мариотта):
В соответствии с формулой (5) изотермический процесс представляется на графике гиперболой, которая называется изотермой (рис.3). | 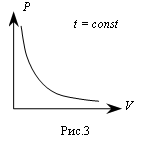
|
2. Для данной массы газа при постоянном давлении 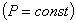 объем газа изменяется линейно с температурой (закон Гей-Люссака):
объем газа изменяется линейно с температурой (закон Гей-Люссака):
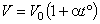 , ,
| (6) |
где 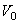 - объем газа при 0oС, V - объем газа при температуре
- объем газа при 0oС, V - объем газа при температуре 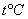 ,
, 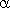 - коэффициент объемного расширения газа.
- коэффициент объемного расширения газа.
3. Для данной массы газа при постоянном объеме 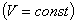 давление газа изменяется линейно с температурой (закон Шарля):
давление газа изменяется линейно с температурой (закон Шарля):
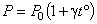 , ,
| (7) |
где 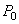 - давление газа при 0oС, P - давление газа при температуре
- давление газа при 0oС, P - давление газа при температуре 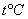 ,
, 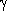 - термический коэффициент давления газа.
- термический коэффициент давления газа.
Оказалось, что для всех газов
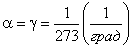 .
.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнениеМенделеева — Клапейрона) — формула, устанавливающая зависимость между давлением,молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
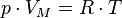 ,
,
где
· 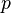 — давление,
— давление,
· 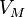 — молярный объём,
— молярный объём,
· 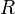 — универсальная газовая постоянная
— универсальная газовая постоянная
· 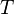 — абсолютная температура, К.
— абсолютная температура, К.
Универса́льная га́зовая постоя́нная (также — постоянная Менделеева)— термин, впервые введённый в употребление Д. Менделеевым в 1874 г. Численно равна работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К.
Универсальная газовая постоянная выражается через произведение постоянной Больцмана на число Авогадро, 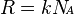 . Универсальная газовая постоянная более удобна при расчетах, когда число частиц задано в молях.
. Универсальная газовая постоянная более удобна при расчетах, когда число частиц задано в молях.
 2015-01-21
2015-01-21 676
676

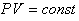 .
.







