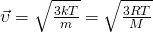
Постоя́нная Бо́льцмана (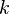 или
или  ) — физическая постоянная, определяющая связь между температурой и энергией. Названа в честь австрийского физика Людвига Больцмана, сделавшего большой вклад в статистическую физику, в которой эта постоянная играет ключевую роль. Её экспериментальное значение в Международной системе единиц (СИ) равно:
) — физическая постоянная, определяющая связь между температурой и энергией. Названа в честь австрийского физика Людвига Больцмана, сделавшего большой вклад в статистическую физику, в которой эта постоянная играет ключевую роль. Её экспериментальное значение в Международной системе единиц (СИ) равно:
 Дж/К[1].
Дж/К[1].
Число соударений молекул обратно пропорционально свободному объему между молекулами, следовательно, и вязкость жидкостей обратно пропорциональна этому свободному объему. [ 2 ]
Число соударений молекул, происходящих в единицу времени, зависит от скорости движения молекул и пропорционально концентрации реагирующих веществ, поскольку от концентрации зависит расстояние между молекулами. В силу этого число соударений в единицу времени увеличивается при увеличении температуры и давления в системе. [ 3 ]
Число соударений молекул очень велико (порядка Ю28 в 1 см3 / сек при обычных условиях), поэтому если бы все столкновения кончались взаимодействием, все реакции проходили бы со скоростью взрыва. Большая же часть наблюдаемых нами в жизни реакций им ет конечную скорость. [ 4 ]
Длина свободного пробега молекулы — это среднее расстояние (обозначаемое 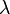 ), которое частица пролетает за время свободного пробега от одного столкновения до следующего.
), которое частица пролетает за время свободного пробега от одного столкновения до следующего.
Длина свободного пробега каждой молекулы различна, поэтому в кинетической теории вводится понятие средней длины свободного пробега (<λ>). Величина <λ> является характеристикой всей совокупности молекул газа при заданных значениях давления и температуры.
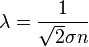 , где
, где 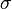 — эффективное сечение молекулы,
— эффективное сечение молекулы, 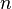 — концентрация молекул.
— концентрация молекул.
22 С тех пор она называется функцией распределения молекул по скоростям или законом Максвелла.
Аналитически она выражается формулой
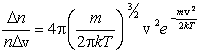 , , |
где m – масса молекулы, k – постоянная Больцмана.
Наиболее вероятная скорость – это скорость, вблизи которой на единичный интервал скоростей приходится наибольшее число молекул. Она рассчитывается по формуле:
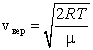 . . |
1 Теплопроводность. Если в первой области газа средняя кинетическая энергия молекул больше, чем во второй, то вследствие постоянных столкновений молекул с течением времени происходит процесс выравнивания средних кинетических энергий молекул, т. е., выравнивание температур. Перенос энергии в форме теплоты подчиняется закону Фурье:
 (1)
(1)
где jE — плотность теплового потока — величина, которая определяется энергией, переносимой в форме теплоты в единицу времени через единичную площадку, перпендикулярную оси х, λ — теплопроводность, — градиент температуры, равный скорости изменения температуры на единицу длины х в направлении нормали к этой площадке. Знак минус говорит о том, что во время теплопроводности энергия перемещается в направлении убывания температуры (поэтому знаки jE и – противоположны). Теплопроводность λ равна плотности теплового потока при градиенте температуры, равном единице.
2 Диффузия.
Явление диффузии для химически однородного газа подчиняется закону Фика:
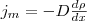 (3)
(3)
где jm — плотность потока массы — величина, определяемая массой вещества, диффундирующего в единицу времени через единичную площадку, перпендикулярную оси х, D — диффузия (коэффициент диффузии), dρ/dx — градиент плотности, который равен скорости изменения плотности на единицу длины х в направлении нормали к этой площадке. Знак минус говорит о том, что перенос массы происходит в направлении убывания плотности (поэтому знаки jm и dρ/dx противоположны). Диффузия D численно равна плотности потока массы при градиенте плотности, равном единице. Согласно кинетической теории газов,
3 Внутреннее трение Как известно, сила внутреннего трения между двумя слоями газа (жидкости) подчиняется закону Ньютона:
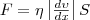 (5)
(5)
где η — динамическая вязкость (вязкость), d ν /dx — градиент скорости, который показывает быстроту изменения скорости в направлении х, перпендикулярном направлению движения слоев, S — площадь, на которую действует сила F.
24 Термодинамика – один из разделов физики, состоящих из наиболее общих физических теорий. Её метод исследования и законы используются в самых разнообразных отраслях науки: в теоретической физике и физике твердого тела, в физической химии, металлургии и металловедении, в теории тепловых машин и в биологии.
Метод термодинамического исследования заключается в применении законов термодинамики к различным процессам и в их логическом развитии с использованием математического аппарата.
Термодинамические системы[править | править вики-текст]
В термодинамике изучаются физические системы, состоящие из большого числа частиц и находящиеся в состоянии термодинамического равновесия или близком к нему. Такие системы называются термодинамическими системами.
Термодинамическое равновесие[править | править вики-текст]
Фундаментальным для классической термодинамики является понятие термодинамического равновесия, которое тоже плохо поддаётся логическому определению и формулируется как обобщение экспериментальных фактов. Утверждается, что любая замкнутая термодинамическая система, для которой внешние условия остаются неизменными, с течением времени переходит в равновесное состояние, в котором прекращаются все макроскопические процессы.
Термодинамические параметры[править | править вики-текст]
Термодинамика не рассматривает особенности строения тел на молекулярном уровне. Равновесные состояния термодинамических систем могут быть описаны с помощью небольшого числа макроскопических параметров, таких как температура, давление, плотность, концентрации компонентов и т. д., которые могут быть измерены макроскопическими приборами.
Термодинамические процессы[править | править вики-текст]
При изменении внешних параметров или при передаче энергии в систему в ней могут возникать сложные процессы на макроскопическом и молекулярном уровне, в результате которых система переходит в другое состояние. Равновесная термодинамика не занимается описанием этих переходных процессов, а рассматривает состояние, устанавливающееся после релаксации неравновесностей.
25. Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяемая отношением бесконечно малого количества теплоты δ Q, полученного телом, к соответствующему приращению его температуры δ T:
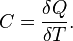
Закон Джо́уля — Ле́нца — физический закон, дающий количественную оценку теплового действия электрического тока. Математически может быть выражен в следующей форме:
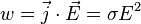
где 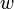 — мощность выделения тепла в единице объёма,
— мощность выделения тепла в единице объёма, 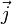 — плотность электрического тока,
— плотность электрического тока, 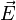 — напряжённость электрического поля, σ — проводимость среды, а точкой обозначено скалярное произведение.
— напряжённость электрического поля, σ — проводимость среды, а точкой обозначено скалярное произведение.
В интегральной форме этот закон имеет вид
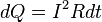
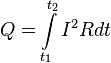
где dQ — количество теплоты, выделяемое за промежуток времени dt, I — сила тока, R — сопротивление, Q — полное количество теплоты, выделенное за промежуток времени от t1 до t2. В случае постоянных силы тока и сопротивления:
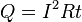
Формула Майера для удельных теплоёмкостей:
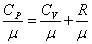 . . |
или
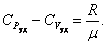 . . |
СПОСОБЫ ИЗМЕРЕНИЯ ТЕПЛОЕМКОСТИ
Импульсный метод измерения теплоемкости металлов(проводников).
В импульсном методе измерения теплоемкости,через испытуемый образец
металла, пропускают электрический ток известной силы. При пропускании
через образец импульсов тока прямоугольной формы наблюдается
пилообразное изменение температуры металла. Линейность процессов
нагревания и остывания достигается использованием образцов малой массы
и объема.Выяснено, что метод обеспечивает высокую точность, и основной
вклад в погрешность измерений вносят погрешности приборов,
несовершенство прямоугольных импульсов. Суммарная погрешность
составляет 6%.
КАЛОРИМЕТРИЧЕСКИЙ СПОСОБ ИЗМЕРЕНИЯ
ТЕПЛОЕМКОСТИ.
Действия по измерению теплоемкости с помощью калориметра.Сводятся к
вводу в калориметр известного количества теплоты и измерению вызванного
этим изменения температуры изучаемого вещества.
26. Обратимые и необратимые процессы, пути изменения состояния термодинамической системы. Процесс называют обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Обратимый процесс - идеализированный случай, достижимый лишь при бесконечно медленном изменении термодинамических параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы называют необратимым. Необратимые процессы могут протекать самопроизвольно только в одном направлении; таковы диффузия,теплопроводность, вязкое течение и другое. Для химической реакции применяют понятия термодинамической и кинетической обратимости, которые совпадают только в непосредственной близости к состоянию равновесия.
Совокупность тел любой физической природы и любого химического состава, характеризуемая некоторым числом макроскопических параметров, называется термодинамической системой. Для описания состояния простейшей термодинамической системы необходимо знать ее температуру t, объем V и давление р, так называемые термодинамические (макроскопические) параметры.
Опыт показывает, что система, предоставленная самой себе, по прошествии некоторого промежутка времени приходит в состояние, в котором каждый параметр имеет одинаковое значение во всех точках системы и остается неизменным с течением времени. Такое состояние называется равновесным или состоянием термодинамического равновесия.
Возможны и такие состояния системы, в которых какой-либо из параметров имеет неодинаковые значения в ее различных точках, т.е. не существует единого значения данного параметра для всей системы. В этом случае равновесие еще не установилось, и такое состояние называется неравновесным.
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём илитемпература — остаются неизменными. Так, неизменному давлению соответствует изобарный процесс, объёму — изохорный, температуре — изотермический, энтропии —изоэнтропийный (например, обратимый адиабатический процесс). Линии, изображающие данные процессы на какой-либо термодинамической диаграмме, называются изобара,изохора, изотерма и адиабата соответственно. Изопроцессы являются частными случаями политропного процесса.
Изобарный процесс (др.-греч. ισος, isos — «одинаковый» + βαρος, baros — «вес») — процесс изменения состояния термодинамической системы при постоянном давлении (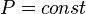 )
)
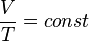
Изохорный процесс[править | править вики-текст]
Основная статья: Изохорный процесс
Изохорный процесс (от греч. хора — занимаемое место) — процесс изменения состояния термодинамической системы при постоянном объёме (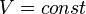 ). Для идеальных газов изохорический процесс описывается законом Шарля: для данной массы газа при постоянном объёме, давление прямо пропорционально температуре:
). Для идеальных газов изохорический процесс описывается законом Шарля: для данной массы газа при постоянном объёме, давление прямо пропорционально температуре:

Круговым процессом (или циклом) называется процесс, при котором система, проходя через ряд состояний, возвращается в первоначальное. На диаграмме цикл изображается замкнутой кривой (рис. 1). Цикл, который совершает идеальный газ, можно разбить на процессы расширения (1—2) и сжатия (2—1) газа. Работа расширения (равна площади фигуры 1a2V2V11) положительна (dV>0), работа сжатия (равна площади фигуры 2b1V1V22) отрицательна (dV<0). Следовательно, работа, которую совершает газ за цикл, равен площади, охватываемой замкнутой кривой. Если за цикл совершается положительная работа A=∫pdV>0 (цикл идет по часовой стрелке), то он называется прямым (рис. 1, а), если за цикл осуществляется отрицательная работа A=∫pdV<0 (цикл идет против часовой стрелки), то он называется обратным (рис. 1, б).
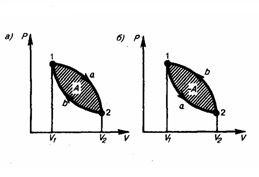
Рис.1
Прямой цикл применяется в тепловых двигателях — периодически действующих двигателях, которые совершают работу за счет полученной извне теплоты. Обратный цикл применяется в холодильных машинах — периодически действующих установках, в которых за счет работы внешних сил теплота переходит к телу с более высокой температурой.
27. адиаба́тный проце́сс (от др.-греч. ἀδιάβατος — «непроходимый») — термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством. первое начало термодинамики в этом случае приобретает вид[7][Комм 1]
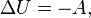
где 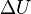 — изменение внутренней энергии тела,
— изменение внутренней энергии тела, 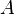 — работа, совершаемая системой.
— работа, совершаемая системой.
Изменения энтропии S системы в обратимом адиабатическом процессе вследствие передачи тепла через границы системы не происходит[8]:
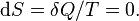
Здесь 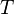 — температура системы,
— температура системы, 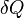 — теплота, полученная системой. Благодаря этому адиабатический процесс может быть составной частью обратимого цикла].
— теплота, полученная системой. Благодаря этому адиабатический процесс может быть составной частью обратимого цикла].
Уравне́ние Пуассо́на — эллиптическое дифференциальное уравнение в частных производных, которое описывает
· стационарное поле температуры,
· поле давления,
· поле потенциала скорости в гидродинамике.
Оно названо в честь знаменитого французского физика и математика Симеона Дени Пуассона.
Это уравнение имеет вид: 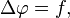
где 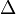 — оператор Лапласа или лапласиан, а
— оператор Лапласа или лапласиан, а 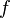 — вещественная или комплексная функция на некотором многообразии.
— вещественная или комплексная функция на некотором многообразии.
В трёхмерной декартовой системе координат уравнение принимает форму:
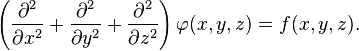
В декартовой системе координат оператор Лапласа записывается в форме 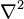 и уравнение Пуассона принимает вид:
и уравнение Пуассона принимает вид:
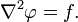
Если f стремится к нулю, то уравнение Пуассона превращается в уравнение Лапласа (уравнение Лапласа — частный случай уравнения Пуассона):
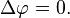
Политропный процесс, политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
В соответствии с сущностью понятия теплоёмкости 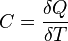 , предельными частными явлениями политропного процесса являются изотермический процесс (
, предельными частными явлениями политропного процесса являются изотермический процесс (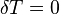 ) иадиабатный процесс (
) иадиабатный процесс (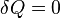 ).
).
В случае идеального газа, изобарный процесс и изохорный процесс также являются политропными (удельные теплоёмкости идеального газа при постоянном объёме и постоянном давлении соответственно равны 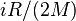 и (
и (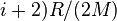 и не меняются при изменении термодинамических параметров).
и не меняются при изменении термодинамических параметров).
Для идеального газа уравнение политропы может быть записано в виде:
pVn = const
где величина называется показателем политропы.
28. В термодинамике цикл Карно́ или процесс Карно — это обратимый круговой процесс, состоящий из двух адиабатических и двухизотермических процессов[1]. В процессе Карно термодинамическая система выполняет механическую работу и обмениваетсятеплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой — холодильником. Пусть тепловая машина состоит из нагревателя с температурой 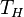 , холодильника с температурой
, холодильника с температурой 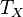 ирабочего тела.
ирабочего тела.
Цикл Карно состоит из четырёх обратимых стадий, две из которых осуществляются при постоянной температуре (изотермически), а две — при постоянной энтропии (адиабатически). Поэтому цикл Карно удобно представить в координатах T (температура) и S (энтропия).
КПД
Количество теплоты, полученное рабочим телом от нагревателя при изотермическом расширении, равно
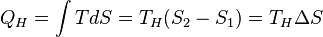 .
.
Аналогично, при изотермическом сжатии рабочее тело отдаёт холодильнику
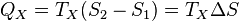 .
.
Отсюда коэффициент полезного действия тепловой машины Карно равен
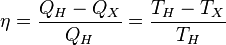 .
.
 2015-01-21
2015-01-21 4028
4028
