Тепловое излучение. Одним из экспериментальных фак- тов, не получивших объяснения в конце XIX в., были спек- тры нагретых тел (спектром называют зависимость интен- сивности излучения от длины волны или частоты излучения). Излучения окружающих нас тел мы обычно не замечаем из- за его слабой интенсивности. С ростом температуры средняя длина волны излучения уменьшается, а его энергия стано- вится больше. Например, приблизившись к огню или печке, мы ощущаем тепло. При нагревании тела (например, железо в печи) раскаляются и начинают светиться. В этом случае
максимум интенсивности излучения смещается к более вы- соким частотам. Тела, которые поглощают всю падающую на них энергию, называются абсолютно черными. Из исследо- ваний зависимости интенсивности излучения от длины вол- ны для абсолютно черных тел был установлен закон смеще-
ния Вина30(рис. 4.1):
λT = b, b = 2.90 · 10–3м · К, (4.1.1)
где длина волны l, соответствующая максимальному значе- нию интенсивности черного тела, обратно пропорциональна его термодинамической температуре Т. Теории, предложен- ные Вином (1896), Релеем (1900) и усовершенствованные Джинсом, не согласовывались с экспериментальными дан- ными во всей области частот. Они удачно описывали лишь часть спектра излучения с небольшими длинами волн (на- чальный участок спектра на рис. 4.1).
|
|
|
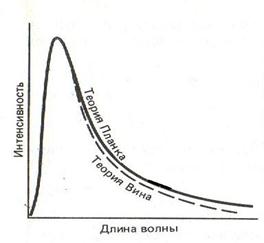
Рис. 4.1. Зависимость излучательной способности черного тела от длины волны

30Закон распределения энергии в спектре равновесного излуче- ния (излучения абсолютно черного тела) в зависимости от темпе- ратуры теоретически был выведен в 1893 г. В. Вином (1864–1928).
Описать спектр излучения абсолютно черного тела, включая законы Вина и Релея–Джинса, смог немецкий физик Планк31. Оказалось, однако, что для вывода этой формулы необходимо принять гипотезу, коренным образом противо- речащую всей системе представлений классической физики,
что энергия микроскопических систем (атомов и молекул) может принимать только определенные, дискретные значе- ния. Таким образом:
E= hν, (4.1.2)
где ν – частота излучения, h – константа, ныне известная под названием постоянной Планка. Эту гипотезу часто называют гипотезой квантов Планка (квант означает «определенное количество», «порция»). С помощью своей гипотезы о суще- ствовании квантов или дискретных порций энергии он полу- чил формулу, описывающую спектральную плотность энер- гетической светимости черного тела. Спектральная плот- ность энергетической светимости r (λ, T) – это энергия, излу- чаемая единицей площади поверхности тела за единицу вре- мени по всем направлениям в единичном интервале длин волн dλ излучения.
|
|
|
Планк вычислил постоянную величину h, современное значение которой равно
h = (6.62176 ± 0.000036) · 10–34Дж · с. (4.1.3)
Признание новизны в данной гипотезе пришло в 1905 г., когда физики, и в первую очередь Эйнштейн32, ввели поня- тие «поля». Эйнштейн выдвинул гипотезу о том, что свет не только испускается и поглощается квантами, но распростра-

31 Макс Планк (1858–1947) – немецкий физик-теоретик, член корреспондент Немецкой академии наук, основатель квантовой теории.
32 А. Эйнштейн (1879–1955) один из величайших физиков всех времен, Нобелевский лауреат, член множества академий разных
стран мира. Им был объяснен фотоэффект, за что был удостоен Нобелевской премии в 1921 г. Он дал интерпретацию броуновско- му движению частиц, заложив основы статистической физики. Им разработана специальная и общая теория относительности, теория возникновения лазерного излучения.
няется также квантами. Таким образом, возникла идея, что свет можно представить в виде частиц – квантов света – фо- тонов. Открытие фотоэффекта33, и объяснение его Эйнштей- ном послужило одним из важных доказательств того, что при взаимодействии с атомом свет может рассматриваться как
частица:
mV 2

= h n - A вых, (4.1.4)
где A вых– работа выхода электрона (или энергия, необходи- мая для отрыва его от поверхности металла), ħν – энергия
mV 2
 фотона,
фотона,
 2
2
– кинетическая энергия электронов.
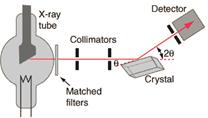
а б
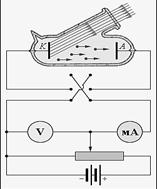
Рис. 4.2. Установка для исследования фото- (а) и комптон- (б) эффектов
На рис. 4.2, а приведена установка, на которой выполня- лись исследования фотоэффекта. Суть эксперимента заклю- чалась в том, что при попадании на катод световых лучей между катодом и анодом возникал ток. Когда освещение ка- тода светом прекращалось, ток пропадал. Если разность по- тенциалов между анодом и катодом уменьшать, то это также приведет к прекращению тока в цепи. Таким образом, оказа-

33 Фотоэффект был открыт в 1887 г. Г. Герцем. Первые детальные исследования фотоэффекта в 1888 г. выполнены профессором Московского университета А.Г. Столетовым (1839–1896).
лось, что существует некоторая пороговая энергия фотона, выше которой он способен отрывать электроны от поверхно- сти металла.
Корпускулярная теория света была подтверждена позже и другими экспериментами. Среди них экспериментально установленный эффект Комптона34– рассеяние фотона на свободном электроне, когда часть энергии падающего фото-
на передается свободному электрону, а энергия самого фото- на при этом уменьшается (рис. 4.2, б). В этих экспериментах было показано, что фотон ведет себя как частица, выбивая из вещества отдельные электроны.
В этих и других экспериментах было установлено удиви- тельное свойство природы – в одних случаях свет следует рассматривать как волну, в других – как частицу. Причем оба подхода объясняют большой класс экспериментальных дан- ных и поэтому правомерны.
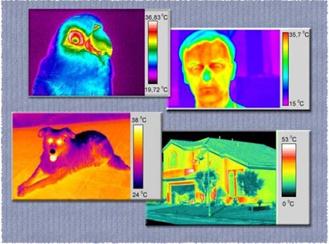
Рис. 4.3. Различные термокарты

34 Комптон (1892–1962) занимался изучением рассеяния коротко- волнового света (рентгеновского излучения) в веществе. Им был открыт эффект рассеяния фотонов на свободных электронах в 1923 г., за который в 1927 г. он получил Нобелевскую премию.
Существуют устройства – тепловизоры, позволяющие по зарегистрированной интенсивности теплового излучения оценить температуру излучающего тела. С их помощью можно, например, определить температуру тела человека, распределение температуры на лице. Они используются в медицинских диагностических целях, в различных исследо- ваниях, связанных с психологией. Информацию представля- ют в виде карт: каждому интервалу поверхностной темпера- туры соответствует определенный цвет и оттенок (рис. 4.3).
Модели атома. Еще в V веке до н.э. Демокрит высказал идею о существовании мельчайших неделимых частиц, кото- рые он назвал атомами. Более двух тысяч лет понадобилось человечеству, чтобы установить существование структуры атома, составными частями которого являются более мелкие частицы. В 1897 г. первая такая частица – электрон – была открыта английским ученым Джозефом Джоном Томсоном.
|
|
|
О сложной структуре атома свидетельствовали и экспе- рименты, выполненные А. Беккерелем35, который, работая с солями урана, обнаружил невидимое излучение, названное им «урановыми лучами». В 1900 году Резерфорду36удалось доказать, что в составе этих лучей есть отрицательно заря- женные частицы, названные им β - частицами, которые, как оказалось позднее, являются электронами.

35 Анри Беккерель (1852–1908) – французский физик, лауреат Нобелевской премии по физике, один из первооткрывателей ра- диоактивности.
22 Эрнест Резерфорд (1871–1937) – английский физик, уроженец
Новой Зеландии, один из создателей учения о радиоактивности и строении атома, основатель научной школы, член всех академий наук мира, иностранный член АН СССР, лауреат Нобелевской премии по химии (1908), член (в 1925–1930 президент) Лондон- ского Королевского общества, директор Кавендишской лаборато- рии (с 1919). Открыл (1899) α -лучи, β -лучи и установил их приро- ду. Создал (1903, совместно с Фредериком Содди) теорию радио- активности. Предложил (1911) планетарную модель атома. Осуществил (1919) первую искусственную ядерную реакцию. Открыл протон и предсказал (1921) существование нейтрона.
Другой вид частиц, входивших в состав урановых лучей, был им назван α -частицами. Как показали исследования, эти частицы имели положительный заряд и массу, в ~7500 раз больше массы электрона. В результате этих открытий стало ясно, что атом имеет сложную структуру – из него вылетают и легкие, и тяжелые частицы.
Среди создаваемых в это время моделей атома наиболь- шую популярность приобрела модель Томсона, получившая название «пудинг с изюмом», представленная на рис. 4.4. Согласно этой модели атом представляет собой положитель- но заряженный шар, внутри которого (как изюм в пудинге) располагаются электроны. При попытке согласовать модель с данными спектроскопии и периодической таблицей Менде- леева, Томсон был вынужден включить в состав модели око- ло тысячи электронов. Они располагались по концентриче- ским кольцам и имели каждый свою частоту колебаний.
|
|
|
Таким образом, модель Томсона оказалась очень сложна и имела большое количество параметров. К тому же она не объясняла целый ряд экспериментальных результатов. При этом она сыграла важную роль в формировании современ- ных представлений об атоме.
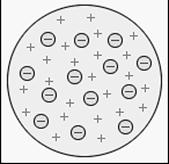
Рис. 4.4. Модель Томсона
Дальнейшее развитие представлений о внутренней стру- ктуре атома было сделано Резерфордом и его учениками.
Планетарная модель атома. Резерфорд со своими уче- никами Г. Гейгером и Э. Марсденом начали исследования внутренней структуры атома с использованием α -частиц.
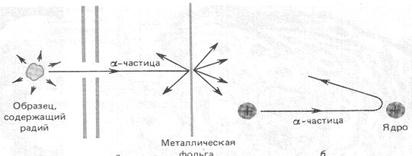
Метод заключался в измерении зависимости числа частиц, рассеянных атомами золотой фольги (золотая фольга легко расплющивалась, что позволяло сделать ее очень тонкой,
~0.4 мкм) под различными углами (рис. 4.5, а). В случае пра- вильности модели Томсона эти углы не должны быть боль- шими, так как электроны, располагающиеся внутри атома много легче α -частиц. В экспериментах частицы после рас- сеивания в золотой фольге попадали на экран, покрытый зернистым цинком. При ударе α -частиц об экран можно было наблюдать, рассматривая его в микроскоп, слабые вспышки (сцинтилляции). Микроскоп с экраном поворачивались во- круг вертикальной оси, что позволяло измерить их число под разными углами. В результате экспериментов, выполненных в конце 1910 г., оказалось, что большинство частиц рассеи- вались под малыми углами (1–2º). Небольшая часть частиц рассеивалась на углы > 2º, а одна из 20 000 частиц на углы 90º и более (рис. 4.5, б). Это сильно противоречило модели Томсона, согласно которой атом представлялся рыхлым и не мог быть причиной отклонения частиц назад.
По мнению Резерфорда, такое могло наблюдаться только в случае, если положительно заряженные α-частицы сталки- ваются с массивным ядром, имеющим маленькие размеры по сравнению с размерами атома. Скорее всего, атом напомина- ет Солнечную систему, где вместо Солнца располагается яд-
ро, а вместо планет – электроны. Размеры ядра по оценкам Резерфорда составляли около 10–14–10–15м. Оказалось, что атом, в основном, пустой. Размеры ядра в 10 000–100 000 раз меньше размеров атома.
Резерфорд предложил планетарную модель атома (рис.
4.5, в), положения которой заключались в следующем:
а) атом пустой и состоит из расположенных в его центре ядра и вращающихся вокруг него электронов;
б) размеры ядра в десятки тысяч раз меньше размеров атома, а его масса составляет более 99.9% массы атома;
в) атом нейтрален, заряд его ядра составляет +Zе, а во- круг него вращается Z электронов.
Модель оказалась простой и изящной. Она объяснила рассеяние частиц на большие углы и назад.
а б
в 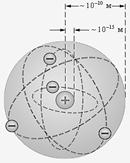
Рис. 4.5. Схема опытов Резерфорда: а) рассеяние α -частицы на золотой фольге; б) редкие рассеяния под большими углами;
в) планетарная модель атома Резерфорда
Модель атома Бора. Развитию представлений об атоме, помимо экспериментов и модели атома, предложенной Ре- зерфордом, способствовал анализ спектров излучения, кото- рые испускают разреженные газы (их линейчатый или дис- кретный характер).
Известно, что нагретые тела излучают свет с непрерыв- ным спектром, когда зависимость интенсивности излучения от частоты описывается непрерывной функцией. Предпола- галось, что это излучение обусловлено колебаниями атомов и молекул, которые зависят в основном от взаимодействия ка- ждого атома или молекулы со своими соседями. Разрежен- ные газы можно также «заставить» испускать свет. Для этого их необходимо возбудить, например, с использованием на- пряжения приложенного таким образом, чтобы разреженный
газ оказался между электродами. Было обнаружено, что спектр излучения разреженных газов является не непрерыв- ным, а дискретным. Так как возбужденные газы испускают свет только определенных длин волн, в спектроскопе или спектрометре наблюдается не непрерывный, а линейчатый спектр. Каждое вещество обладает своим, характерным толь- ко для него спектром испускания (набором частот, на кото- рых происходит поглощение или испускание света данным видом атомов или молекул). Спектр служит своего рода «от- печатком пальцев», позволяющим идентифицировать состав
вещества37.
 Водород представляет собой простейший атом: вокруг ядра обращается только один электрон. У атома водорода самый простой спектр. На рис. 4.6 представлен линейчатый спектр атома водорода.
Водород представляет собой простейший атом: вокруг ядра обращается только один электрон. У атома водорода самый простой спектр. На рис. 4.6 представлен линейчатый спектр атома водорода.
Рис. 4.6. Линейчатый спектр атомарного водорода
Были обнаружены серии линий Бальмера, Лаймена, Па- шена, которые позже были объединены шведским ученым Ридбергом.
В 1913 году Нильс Бор38 показал, что несовпадение с
экспериментом выводов, основанных на модели Резерфорда, возникло не потому, что планетарная модель строения атома неверна. Он предположил, что в микромире физические ве- личины принимают дискретные значения, т.е. квантуются (таким образом, законы микромира – это квантовые законы). В основу своей теории Бор положил следующие постулаты.

37 На этой идее действует и развивается целая область науки – спектрометрия, занимающаяся исследованием вещества по их спектрам. Этот метод используется и при изучении состава звезд, комет и других космических объектов.
38Датский физик Нильс Бор (1885–1962) – лауреат Нобелевской премии по физике 1922 г., присужденной за создание квантовой теории строения атома, автор теории составного ядра.
1. В атоме существуют стационарные (не изменяющиеся со временем) состояния, характеризующиеся определенными дискретными (квантовыми) значениями энергии, находясь в которых атом не излучает энергию.
Стационарным состояниям атома соответствуют стацио- нарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением.
2. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие уравнению
mevnrn= nħ, n = 1,2,3,…, (4.1.5)
где n – квантовое число орбиты или главное квантовое число, vn – скорость электрона, находящегося на n -й орбите атома, rn – радиус n -й орбиты.
3. При переходе электрона с одной орбиты на другую излучается (поглощается) один фотон с энергией, равной разности энергий соответствующих стационарных состоя- ний:
ħν = En– Em, (4.1.6)
где n и m – целые квантовые числа, характеризующие соот- ветствующие энергетические уровни электрона.
Модель Бора прекрасно объяснила серии линий спектра атома водорода (рис. 4.7). Недостатком этой теории является тот факт, что она оказалась справедлива только для атома водорода и водородоподобных ионов, а спектры более слож- ных атомов (например, гелия) и молекул она не объясняла. Не получили объяснения и межатомные связи в молекулах, твердых телах и жидкостях. К тому же в ней существует внутренняя противоречивость, поскольку совмещались ме- тоды расчета, основанные на законах классической механики и электродинамики, с квантовыми представлениями, введен- ными в классическую теорию как постулаты. Не обеспечива- ла она и учет проблемы корпускулярно-волнового дуализма.
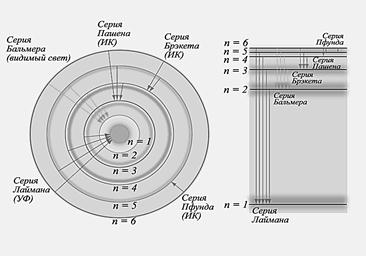
Рис. 4.7. Объяснение серий линий Лаймана, Бальмера, Пашена и др. на основе модели Бора.
 2015-01-21
2015-01-21 1458
1458
