Все вещества состоят измолекул - частиц, каждая из которых определяет все физико-химические свойства вещества.
Молекулы простых веществ (К, Не, О2, Н2, Мо,...) состоят из одного или нескольких атомов одного химического элемента.
Молекулы сложных веществ (UO2, Н3ВО3, В4С,...) состоят из атомов нескольких химических элементов.
Молекулы и составляющие их атомы различаются прежде всего по их массе. Для удобства сравнения массы различных молекул (атомов) принято измерять в относительных единицах, называемых атомными единицами массы (а.е.м.).
1 а.е.м. - это 1/12 часть массы изотопа атома углерода-12. В единицах системы СГС (которая чаще всего используется в нейтронно-физических расчетах) 1 а.е.м. эквивалентна 1,660567.10-24 г . Относительная масса молекулы или атома, выраженная в а.е.м., называется молекулярной (или атомной соответственно) массой и обозначается символом А.
Пространственную плотность молекул (атомов) в различных веществах принято оценивать величиной молекулярной (атомной) концентрации, то есть числом молекул (атомов), содержащихся в единице объёма вещества.
Опираясь на следствие закона Авогадро о том, что число молекул в 1 моле1) вещества - величина постоянная (называемая числом Авогадро NА = 6,0221.1023 моль-1), молекулярная концентрация любого вещества легко рассчитывается по известным величинам плотности g и молекулярной массы А вещества по формуле:
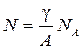 . .
| (1.1) |
В единицах системы СГС размерность вычисленной по формуле (1.1) величины молекулярной концентрации – см -3.
1) Молем какого-либо вещества называется количество этого вещества, содержащее столько молекул, сколько атомов содержится в 12 граммах изотопа углерода 12С.
Таким образом, получается:
а) для простых веществ, каждая молекула которых содержит только один атом, молекулярная концентрация вещества по величине совпадает с атомной концентрацией и вычисляется по формуле (1.1);
б) для сложных веществ, каждая молекула которых содержит m сортов атомов различных химических элементов, молекулярная концентрация также находится по формуле (1.1), в которой молекулярная масса
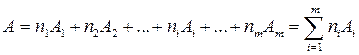 , ,
| (1.2) |
находимая по правилам химии, представляет собой сумму масс всех компонентов молекулы вещества; (здесь ni - число атомов каждого компонента в молекуле вещества, а Ai - атомная масса i-го компонента);
Пример. Кристаллическая борная кислота H3BO3 плотностью g = 1,28 г/см3 будет иметь относительную молекулярную массу:
А = 3 А н+1 А в+3 А о = 3. 1 + 1 .10,81 + 3 .16 = 61,81 а.е.м.,
а, следовательно, её молекулярная концентрация будет равна:
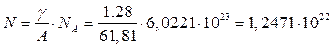 см-3.
см-3.
в) атомные концентрации компонентов сложных веществ находятся по общей формуле:
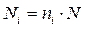
| (1.3) |
где ni - число атомов i-го компонента в каждой молекуле вещества, а N - молекулярная концентрация вещества.
Пример. В упомянутом выше примере борной кислоты:
- атомная концентрация водорода Nн= 3N = 3 .1,2471.1022 = 3,7413 .1022 см -3, т.к. в каждой молекуле борной кислоты содержится по три атома водорода;
- атомная концентрация бора Nв = N = 1,2471 .1022 см -3, т.к. в молекуле борной кислоты содержится только один атом бора;
- атомная концентрация кислорода No= 3N = 3 . 1,2471 .1022 = 3,7413 .1022 см -3, т.к. в каждой молекуле борной кислоты по три атома кислорода.
г) атомные концентрации в простых многоатомных веществах, очевидно, можно рассматривать как частность случая (в) и находить по общей формуле (1.3).
Пример. Молекула йода (J2) содержит по два атома химического элемента йода, поэтому атомная концентрация йода в кристаллическом йоде плотностью g = 4,9 г/см3 будет равна
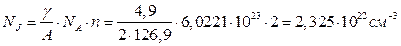 . .
| (1.4) |
 2015-01-21
2015-01-21 602
602








