Барометрическая формула:
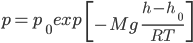 ,
,
где p — давление газа в слое, расположенном на высоте h,
p0 — давление на нулевом уровне h = h0,
M — молярная масса газа,
R — газовая постоянная,
T — абсолютная температура.
В присутствии гравитационного поля (или, в общем случае, любого потенциального поля) на молекулы газа действует сила тяжести. В результате, концентрация молекул газа оказывается зависящей от высоты в соответствии с законом распределения Больцмана:
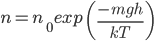
Где:
n — концентрация молекул на высоте h,
n0 — концентрация молекул на начальном уровне h = 0,
m — масса частиц,
g — ускорение свободного падения,
k — постоянная Больцмана,
T — температура.
32.
Работа газа при изменении его объема
Газ оказывает давление на любую стенку сосуда. Если стенка подвижна, то сила давления F совершит работу A, переместив поршень на расстояние DL.
Если DL невелико, то давление газа останется примерно постоянным. Тогда работа будет равна:
A = F·DL·cosa = P·S·DL,
где S - площадь поршня,
a - угол между направлением силы и перемещением поршня (a = 0).
Произведение S·DL равно изменению объема газа DV от начального V1 до конечного V2 значения, т.е. S·DL =DV = V1 - V2. Тогда
A = P·(V2 - V1) = P·DV.
В изобарном процессе расширения газа P = const. Следовательно, при любом сколь угодно большом увеличении объема сила давления газа на поршень будет постоянной, и формула работы сохранит свой вид
A = P·(V2 - V1).
37.
Понятие энтропии.
Термодинамическая энтропия S, часто просто именуемая энтропия, — физическая величина, используемая для описаниятермодинамической системы, одна из основных термодинамических величин. Энтропия является функцией состояния и широко используется в термодинамике, в том числе химической.
40.
Тепловая маши́на — устройство, преобразующее тепло в механическую работу (тепловой двигатель) или механическую работу в тепло (холодильник). Преобразование осуществляется за счёт изменения внутренней энергии рабочего тела — на практике обычно жидкость или газ.
44.
Фа́зовый перехо́д (фазовое превращение) в термодинамике — переход вещества из одной термодинамической фазы в другую при изменении внешних условий. С точки зрения движения системы по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и т. п.), фазовый переход происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
Переход вещества от одной фазы в другую – фазовый переход – всегда связан с качественными изменениями свойств вещества. Примером фазового перехода могут служить изменения агрегатного состояния вещества или переходы, связанные с изменениями в составе, строении и свойствах вещества (например, переход кристаллического вещества из одной модификации в другую).
Различают фазовые переходы двух родов. Фазовый переход первого рода (например, плавление, кристаллизация и т.д.) сопровождается поглощением или выделением вполне определённого количества теплоты, называемой теплотой фазового перехода.
Фазовые переходы первого рода характеризуются постоянством температуры, изменениями энтропии и объёма. Объяснение этому можно дать следующим образом. Например, при плавлении телу нужно сообщить некоторое количество теплоты, чтобы вызвать разрушение кристаллической решётки. Подводимая при плавлении теплота идёт не на нагрев тела, а на разрыв межатомных связей, поэтому плавление протекает при постоянной температуре. При подобных переходах – из более упорядоченного кристаллического состояния в менее упорядоченное жидкое состояние – степень беспорядка увеличивается и, с точки зрения второго начала термодинамики, этот процесс связан с возрастанием энтропии системы. Если переход происходит в обратном направлении (кристаллизация), то система теплоту выделяет.
Верхняя ветвь отвечает кристаллическому состоянию, а нижняя ветвь представляет свободную энергию парообразной фазы. При низких температурах свободная энергия кристалла меньше, чем пара, и, следовательно, кристаллическое состояние выгоднее. При высоких температурах, наоборот, выгоднее существование парообразного состояния.
При теоретическом описании фазовых переходов первого рода каждую из фаз обычно описывают отдельно. Так, кристаллическую ветвь рассматривают, пользуясь моделью идеального кристалла, т. е. предполагая регулярное расположение всех атомов. Парообразную же ветвь получают, используя модель идеального газа, предполагающую полный беспорядок в системе. Зависимости, полученные для различных моделей, накладывают друг на друга и исследуют, какая из возможностей реализуется в данных условиях. Получить описание фазового перехода первого рода, одновременно учитывая все состояния системы, до настоящего времени не удается из-за огромных математических трудностей.
Фазовые переходы, не связанные с поглощением или выделением теплоты и изменением объёма, называются фазовыми переходами второго рода. Эти переходы характеризуются постоянством объёма и энтропии, но скачкообразным изменением теплоёмкости. Общая трактовка фазовых переходов второго рода предложена советским учёным Л.Д.Ландау (1908-1968). Согласно этой трактовке, фазовые переходы второго рода связаны с изменением симметрии: выше точки перехода система, как правило, обладает более высокой симметрией, чем ниже точки перехода. Примерами фазовых переходов второго рода являются: переход ферромагнитных веществ (железа, никеля) при определённых давлении и температуре в парамагнитное состояние; переход металлов и некоторых сплавов при температуре, близкой к 0К, в сверхпроводящее состояние, характеризуемое скачкообразным уменьшением электрического сопротивления до нуля; превращение обыкновенного жидкого гелия при Т=2,9К в другую жидкую модификацию, обладающую свойствами сверхтекучести.
50.
Первый и основной закон диффузии установлен в середине прошлого века швейцарским физиком А. Фиком. Часто его так и называют - закон Фика.
Это простое, чисто эмпирическое правило. Предположим, что концентрация диффундирующего вещества в точке Х равна G, а в точке х2 - С2 и С2 > G. Закон Фика утверждает, что диффузионный поток вещества направлен из точки х% в точку х, а его величина пропорциональна крутизне концентрационного перепада, равного Сг - С Наглядность этого закона станет особенно очевидной, если вы представите себе скатывающегося с горы лыжника.
Его скорость тем больше, чем круче склон. Это же утверждение составляет суть закона Фика, где роль перепада высот играет перепад концентраций. Обычно миграцию вещества характеризуют плотностью его потока. Так называется количество вещества (выраженное, например, в молях), проходящее через единичную площадь поперечного сечения за единицу времени. Зная плотность потока, ничего не стоит определить количество продиффундировавшего вещества.
53.
Закон Кулона - это закон взаимодействия двух неподвижных точечных зарядов. Закон Кулона формулируется следующим образом: Сила электрического взаимодействия между двумя точечными зарядами в вакууме пропорциональна этим зарядам и обратно пропорциональна квадрату расстояния между ними.
При взаимодействии одноименные заряды отталкиваются, разноименные притягиваются. Силы Кулона направлены по прямой, соединяющей заряды.
Закон Кулона для взаимодействия точечных зарядов Q1 и Q2, находящихся на расстоянии r друг от друга, записывается формулой:
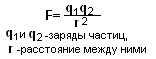
Принцип суперпозиции
Если поле образовано не одним зарядом, а несколькими, то силы, действующие на пробный заряд, складываются по правилу сложения векторов. Поэтому и напряженность системы зарядов в данной точке, поля равна векторной сумме напряженностей полей от каждого заряда в отдельности.
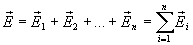
56.
ПОТЕНЦИАЛ – энергетическая характеристика электрического поля. ПОТЕНЦИАЛ численно равен потенциальной энергии, которой обладает в данной точке поля единичный положительный заряд.
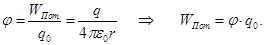
ЭКВИПОТЕНЦИАЛЬНЫМИ ПОВЕРХНОСТЯМИ называются поверхности равного потенциала (φ = const). Работа по перемещению заряда вдоль эквипотенциальной поверхности равна нулю.
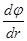 - градиент потенциала.
- градиент потенциала.

Напряженность поля равна градиенту потенциала, взятому со знаком минус.
Градиент потенциала показывает, как меняется потенциал на единицу длины. Градиент перпендикулярен функции и направлен в сторону возрастания функции. Следовательно, вектор напряженности перпендикулярен эквипотенциальной поверхности и направлен в сторону убывания потенциала.
Циркуляцией вектора напряженности называется работа, которую совершают электрические силы при перемещении единичного положительного заряда по замкнутому пути L
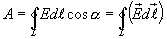
Так как работа сил электростатического поля по замкнутому контуру равна нулю (работа сил потенциального поля), следовательно циркуляция напряженности электростатического поля по замкнутому контуру равна нулю.

 2015-01-21
2015-01-21 647
647







