| ионная | атомная | молекулярная | металлическая | |
| Что в узлах кристаллической решётки, структурная единица | ионы
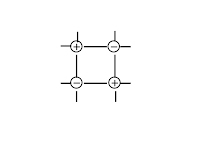
| атомы
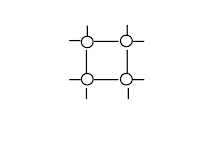
| молекулы
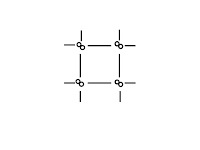
| атомы и катионы
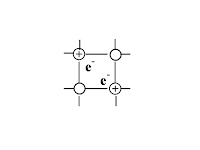
|
| Тип химической связи между частицами узла | ионная | ковалентная: полярная и неполярная | ковалентная: полярная и неполярная | металлическая |
| Силы взаимодействия между частицами кристалла | электростати- ческие | ковалентные | межмолекуляр- ные | электростати- ческие |
| Физические свойства, обусловленные кристаллической решёткой | · силы притяжения между ионами велики, · Тпл.↑ (тугоплавкте), · легко растворяются в воде, · расплав и р-р проводит эл.ток, · нелетучи (не имеют запаха) | · ковалентные связи между атомами велики, · Тпл.и Tкип очень↑, · в воде не растворяются, · расплав не проводит эл.ток | · силы притяжения между молекулами невелики, · Тпл.↓, · некоторые растворяются в воде, · обладают запахом – летучи | · силы взаимодействия велики, · Тпл.↑, · Высокие тепло и электропроводность |
| Агрегатное состояние вещества при обычных условиях | твёрдое | твёрдое | твёрдое, газообразное, жидкое | твёрдое, жидкое(Нg) |
| Примеры | большинство солей, щелочей, оксиды типичных металлов | С (алмаз, графит), Si, Ge, B, SiO2, CaC2, SiC (карборунд), BN, Fe3C, TaC(tпл.=38000С) Красный и чёрный фосфор. Оксиды некоторых металлов. | все газы, жидкости, большинство неметаллов: инертные газы, галогены, H2, N2, O2, O3, P4 (белый), S8. Водородные соединения неметаллов, оксиды неметаллов: H2O, CO2 «сухой лёд». Большинство органических соединений. | Металлы, сплавы |
Физические типы кристаллических решёток
|
|

Сейчас читают про:
 2015-01-21
2015-01-21 570
570







