При повышении температуры скорость химической реакции как правил возрастает.
Правило Вант-Гоффа:
При повышении температуры на каждые 10 ⁰ скорость химической реакции возрастает в 2 – 4 раза.
Математическое выражение правило Вант-Гоффа имеет следующий вид:
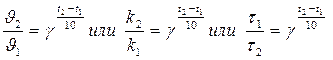 ,
,
Где ϑ1 и ϑ2 – скорости химической реакции, k2 и k1 - константы скоростей, τ1 и τ2 – время, за которое реакция протекает при температурах t2 и t1, соответственно; γ – температурный коэффициент химической реакции (обычно его значения находятся в интервале от 2 до 4).
Это эмпирическое правило, оно не выполняется при высоких температурах.
Более точно зависимость константы скорости от температуры выражается уравнением Аррениуса:
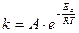 ,
,
где k - константа скорости при температуре Т (в К), R – универсальная газовая постоянная (8,31 Дж/(моль∙К)), А – предэкспоненциальный множитель, Еа – энергия активации (Дж/моль).
Энергия активации (Еа) – это энергетический барьер, который должны преодолеть исходные вещества по пути превращения в продукты реакции. Еа важная характеристика химической реакции. Аналитический способ расчета энергии активации имеет следующий вид:
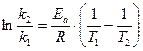 .
.
Выражая из данного уравнения энергию активации, получаем следующую формулу:
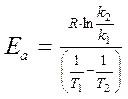 ,
,
где k2 и k1 - константы скоростей при температурах Т2 и Т1, соответственно.
Задачи для самостоятельного решения:
На правило Вант-Гоффа
1. При 150°С химическая реакция заканчивается за 16 мин. Принимая температурный коэффициент скорости равным 2,5, рассчитайте через сколько минут закончилась бы эта реакция при 200°С и при 80°С.
2. При 20°С реакция протекает за 2 мин. За сколько времени будет протекать реакция при 50°С? Температурный коэффициент скорости реакции равен 2.
3. Во сколько раз увеличится скорость химической реакции при повышении температуры от 200 до 275°С, если температурный коэффициент равен 2?
4. Во сколько раз увеличится константа скорости химической реакции при повышении температуры от 120 до 160°С, если температурный коэффициент равен 3?
1. Константа скорости реакции СО(г) + Cl2(г) = СОCl2(г) при 349 °С равна 3,81, а при 395 ° С – 15,5. Вычислите ее энергию активации.
2. Константа скорости реакции при 298 К и 323 К соответственно равна 0,0093 и 0,0806 мин-1. Рассчитайте энергию активации этой реакции.
3. Для реакции омыления уксусноэтилового эфира при большом избытке воды константа скорости при 20°С равна 0,00099 мин-1, а при 40°С ее величина составляет 0,00439 мин-1. Рассчитайте энергию активации этой реакции.
 2015-01-21
2015-01-21 2206
2206
