Термодинамические и кинетические закономерности химических процессов.
Под химическим процессом в реакторе понимают химическую реакцию или совокупность нескольких реакций и сопутствующие ей явления массо- и теплопереноса. Для удобства рассмотрения в химическом реакторе можно условно выделить три зоны, в каждой из которой протекают процессы, подчиняющиеся различным закономерностям: зону подвода реагирующих веществ в зону химических реакций, зону химических реакций и зону отвода продуктов из зоны химических реакций.
В первой и третьей зонах протекают физические процессы подвода и отвода веществ, подчиняющиеся общим законам массопередачи. Закономерности массопередачи определяются законами фазового равновесия, движущей силой процесса и коэффициентами скорости массообменных процессов. Массопередача осуществляется путем молекулярной диффузии, конвекции, испарения, абсорбции и десорбции.
Ускорение этих процессов и повышение скорости поступления реагентов в зону химической реакции и интенсификация работы химического реактора может быть достигнуто путем перемешивания системы, ускоряющим диффузию компонентов и интенсификацией подачи компонентов за счет их распыления и увеличения скорости потока.
В зоне химического реактора протекает ряд последовательных или параллельных химических реакций, каждая из которых характеризуется скоростью (кинетический фактор) и состоянием равновесия в системе (термодинамический фактор):
k1 k2
А → В → D
← ←
k1
А → В
 ←
←
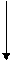
k2
D
Следовательно, для оценки протекающих в этой зоне явлений, необходимо исследовать влияние различных факторов на скорость химической реакции и полноту протекания ее, то есть на состояние равновесия в системе.
Скорость химической реакции (кинетические закономерности)
Скорость химической реакции, протекающей в реакторе, описывается уравнением:
U = K ∙ α ∙ ∆C.,
Где: K – константа, α – параметр, характеризующий состояние реагирующей системы, ∆C – градиент концентрации, представляющий собой частный случай движущей силы процесса (реакции).
Движущей силой процесса (ДС) или градиентом параметра называется разность между предельными значениями данного параметра (Т, Р, С и др.) и его действительным значением в данный момент времени, то есть ∆Т, ∆Р, С и др. Очевидно, чем больше движущая сила процесса при постоянстве других параметров, тем выше скорость характеризуемого этим параметром процесса.
Величины K и α имеют различное значение в случае гомогенных и гетерогенных систем. Для реакций протекающих в гомогенных системах скорость определяется количеством полученного целевого продукта в единицу времени в единице объема системы (реакционный объем) и может быть представлена уравнением:
Uгом = k V ∆C.,
где: k – константа скорости химической реакции,
V – реакционный объем, величина которого обратно пропорциональна времени контактирования.
Для реакций, протекающих в гетерогенных системах, количество полученного целевого продукта в единицу времени относят к единице поверхности соприкосновения фаз, на которой протекает реакция, что может быть представлено уравнением:
Uгет = kм F ∆C.,
Где: kм – коэффициент массопередачи, представляющий количество вещества в килограммах, переданного из одной фазы в другую через поверхность раздела фаз равную одному квадратному метру при градиенте концентрации равном 1 кг/м3 в течении одного часа, м/ч,
F – поверхность раздела фаз, м2.
Выражение для движущей силы процесса ∆C зависит от обратимости химической реакции. Для необратимых гомогенных реакций:
Aa + Bb = Dd ± ∆H
Движущая сила процесса равна произведению конечных (то есть на выходе из реактора) концентраций реагирующих веществ в степенях их стехиометрических коэффициентов:
∆C = CaA ∙ CbB
Для обратимых гомогенных реакций
Aa + Bb → Dd
←
Движущая сила процесса представляет произведение разностей конечных (на выходе из реактора) концентраций реагирующих веществ и их равновесных концентраций:
∆C = (CA – C*А)a(CB – C*B)b.
где: CA, CB – концентрация веществ на выходе из реактора,
C*А, C*B – равновесная концентрация веществ.
Для обратимых гетерогенных реакций движущая сила процесса описывается этим же уравнением (C – действительная концентрация вещества в передающей фазе, C* - равновесная концентрация над воспринимающей фазой).
Очевидно, что для обратимых реакций условие C = C* превращает ∆C в нуль и процесс прекращается.
Одним из важнейших условий интенсификации ХТП, от которого зависят производительность и размеры аппараты, является повышение скорости химической реакции. В общем случае она является функцией четырех переменных: константы скорости или коэффициента массопередачи k (kм), движущей силы процесса ∆C, реакционного объема V, поверхности раздела фаз F, увеличение каждой из которых увеличивает скорость реакции.
1. Константа k (kм) представляет собой сложный параметр, значение которого зависит от химической природы и физических характеристик реагентов, их агрегатного состояния, гидродинамики процессов, конструкции реактора. Она может быть за счет повышения температуры, использования катализатора, усиления турбулизации системы путем перемешивания и усиления конвекции.
2. Реакционный объем V связан со временем пребывания реагентов в зоне химической реакции (временем контактирования) и его увеличение определяет возможность достижения равновесия медленно идущих химических реакций.
3. При увеличении поверхности раздела соблюдается общее правило, согласно которому увеличивают поверхность более плотной фазы, омываемой менее плотной фазой, то есть соблюдается условие ρ1 > ρ2, где ρ1 – плотность более плотного, а ρ2 – менее плотного компонента. Увеличение поверхности раздела достигается:
· для системы «газ - жидкость» созданием пленки жидкости, стекающей по насадке, вспениванием жидкости, барботированием газа через жидкость;
· для системы «газ – твердое тело» фильтрацией газа через твердую фазу и перемешиванием;
· для системы «жидкость – твердое тело» измельчением твердой фазы, использованием принципа «кипящего слоя», непрерывным омыванием твердой фазы жидкостью;
· для системы «жидкость - жидкость» интенсивным перемешиванием, созданием эмульсии.
4. Увеличение движущей силы ∆C обеспечивается:
· повышением концентрации реагентов за счет использования более концентрированного сырья;
· увеличением давления для систем с участием газообразных веществ;
· уменьшением концентрации продуктов реакции отводом их из системы;
· изменением температуры и, как следствие, интенсификация процессов сорбции и десорбции реагентов и продуктов реакции.
 2015-01-21
2015-01-21 2953
2953
