Поскольку для гетерогенных систем процессы в зонах реактора I и III и II подчиняются различным законам, они протекают с различной скоростью. Общая скорость химического процесса в реакторе определяется скоростью наиболее медленной его стадии. Здесь возможны два крайних случая.
1. Скорость химической реакции (в зоне II) меньше скорости физических процессов подвода реагентов и отвода продуктов (в зонах I и III):
Uхр < Uподв(отв).
В этом случае химический процесс лимитируется скоростью химической реакции и ускоряется факторами, влияющими на нее: повышение температуры, увеличение концентрации реагентов, повышения давления (для газообразных систем). Принято говорить, что в этом случае гетерогенный химический процесс протекает в кинетической области.
2. Скорость химической реакции (в зоне II) больше скорости физических процессов подвода реагентов и отвода продуктов (в зонах I и III):
Uхр > Uподв(отв).
В этом случае химический процесс лимитируется процессами диффузии (массопереноса) компонентов к поверхности раздела фаз и обратно и ускоряется факторами, влияющими на диффузию: повышение градиента концентрации (ДС), перемешивание, гомогенизация системы. Принято говорить, что в этом случае гетерогенный химический процесс протекает в диффузионной области.
Очевидно, что зависимость скорости процесса от важнейшего фактора – температуры в этих областях различна. В кинетической области скорость химического процесса является сильной функцией температуры, в диффузионной области скорость практически не зависит от температуры. 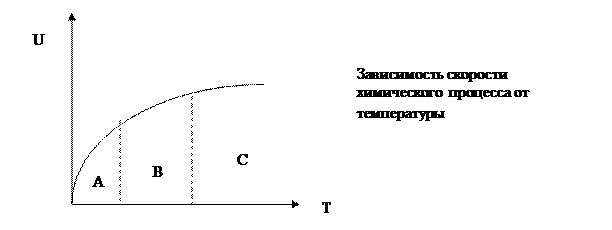
Следовательно, в зоне А процесс протекает в кинетической области U = f (T), а в зоне С – в диффузионной области U ≠ f (T). Зона В является переходной зоной.
При изменении условий (в данном случае температуры) гетерогенный химический процесс может переходить из одной области в другую, при этом воздействовать на скорость его будут уже другие факторы.
Равновесие в системе (термодинамические закономерности)
Выход целевого продукта химического процесса в реакторе определяется степенью приближения реакционной системы к состоянию устойчивого равновесия. Устойчивое равновесие отвечает следующим условиям:
· неизменность равновесного состояния системы во времени при постоянстве внешних условий;
· подвижность, то есть самопроизвольное восстановление равновесия после снятия внешнего воздействия;
· динамический характер, то есть установление и сохранение равновесия вследствие равенства скоростей прямого и обратного процессов;
· возможность воздействия на состояние равновесия как со стороны прямой, так и обратной реакции;
· минимальное значение энергии Гибсса в изобарно-изотермических процессах и энергии Гельмгольца в изохорно-изотермических процессах.
Степень приближения системы к состоянию устойчивого равновесия характеризуется изменением изобарно-изотермического потенциала и равновесной степенью превращения. Изменение изобарно-изотермического потенциала ∆G определяет термодинамическую вероятность протекания реакции в данных условиях и глубину ее протекания. Изменение изобарно-изотермического потенциала равно разности между изменениями его для конечных продуктов реакции и исходных реагентов. Так для реакции:
Aa + Bb = Dd ± ∆H,
∆G = d∆GD – (a∆GA + b∆GB)
Знак и порядок величины ∆G позволяет оценить состояние равновесия системы. Так при ∆G<0 наиболее вероятной является прямая реакция, причем, чем более это неравенство, тем более вероятно подобное направление процесса, при ∆G>0 наиболее вероятной является обратная реакция, значение ∆G=0 отвечает состоянию равновесия системы.
Из зависимости:
∆G =∆H –T∆S,
Где: ∆H и ∆S стандартные энтальпия и энтропия системы, следует, что на смещение равновесия в сторону прямой реакции благоприятно влияют большое отрицательное значение ∆H (значительный тепловой эффект реакции) и большое положительное значение ∆S. Так как энтропийный член входит в уравнение в виде произведения T∆S, то повышение температуры усиливает влияние, оказываемое изменением энтропии.
Очевидно, что условием равновесия (∆G=0) является равенство ∆H=T∆S, то есть влияние энергетического и энтропийного факторов уравнивается. При относительно невысоких температурах ∆G ≈∆H и характеристикой вероятности протекания реакции может служить тепловой эффект ее и чем более экзотермична реакция, тем более она вероятна.
Для оценки состояния равновесия в реакторе обычно используют равновесную степень превращения (равновесный выход продукта). Равновесной степенью превращения (Х*) называется степень превращения исходных веществ в продукты реакции, отвечающая состоянию устойчивого равновесия системы. Равновесная степень превращения характеризует глубину протекания процесса, степень приближения его результатов к оптимальным в данных условиях. Она функционально связана с константой равновесия, причем характер этой зависимости определяется порядком реакции. Так, для реакции первого порядка:
КР = Х*Р/(1- Х*Р) или Х*Р = КР/ (1+ КР)
Для реакций второго порядка:
КР = 4Х*Р/(1- Х*Р)Р
Зависимость между константой равновесия и равновесной степенью превращения является одной из важнейших в химической технологии, так как последняя характеризует условия максимально возможного извлечения целевого продукта из сырья.
Смещение равновесия в сторону образования целевого продукта может быть достигнуто изменением температуры, давления и концентрации реагентов и продуктов реакции.
1. Влияние температуры. Из уравнения Вант-Гоффа:
d lnK/ d Т = ∆ H°/RT2
следует, что так как K = f (T). то и равновесная степень превращения Х* зависит от температуры. Характер этой зависимости определяется знаком теплового эффекта реакции.

На рисунке представлена зависимость равновесной степени превращения от температуры при постоянных значениях концентрации, давления и времени контактирования. Следует, что для эндотермических реакций повышение температуры сдвигает равновесие в сторону образования продуктов реакции, то есть увеличивает равновесную степень превращения, а в случае экзотермической реакции – наоборот, что согласуется с принципом Ле-Шателье.
2. Влияние давления. Изменение давления существенно влияет на состояние равновесия в газообразных системах. Здесь возможны три случая:
· Объем газообразной системы уменьшается (∆V<0), например, в реакции СО + 2Н2 ↔ СН3ОН. В этом случае повышение давления смещает равновесие в сторону образования продуктов реакции;
· Объем газообразной смеси увеличивается (∆V>0), например, в реакции СН4 ↔ С + 2Н2.В этом случае смещение равновесия в сторону образования продуктов реакции достигается понижением давления;
· Объем газообразной смеси не изменяется, например, в реакции СО + Н2О ↔ СО2 + Н2. В этом случае изменение давления не влияет на равновесную степень превращения, а только на скорость реакции.
3. Влияние концентрации. Изменение концентрации (парциального давления) реагирующих веществ и продуктов реакции существенно влияет на состояние равновесия системы. При этом повышение концентрации исходных веществ смещает равновесие в сторону образования продуктов реакции и повышает равновесную степень превращения. Аналогично влияет уменьшение концентрации продуктов реакции, то есть вывод их из равновесной системы. Так, например, для реакции
СО + Н2О ↔ СО2 + Н2.
Равновесная степень превращения и, следовательно, равновесное парциальное давление водорода возрастает с увеличением парциального давления паров воды и понижением парциального давления диоксида углерода.
Знание равновесной степени превращения и ее зависимости от различных факторов химического процесса позволяет рассчитывать равновесный состав продуктов процесса, оценивать влияние различных условий на состояние равновесия системы в химическом реакторе, определять тепловой режим и другие параметры процесса.
Р.С. Соколов, Химическая технология, том 1, Москва, 2000,
 2015-01-21
2015-01-21 2828
2828
