Общая химическая технология
Равновесие химических реакций.
Для химических реакций равновесным считается состояние, в которое приходит система при постоянных внешних условиях, характеризуемое неизменностью во времени термодинамических параметров и отсутствием в системе потока вещества и теплоты.
Устойчивое равновесие характеризуется:
1)неизменностью во времени при постоянных внешних условиях;
2)подвижностью равновесия – самопроизвольным восстановлением равновесия после снятия внешнего воздействия;
3)динамическим характером – равенство скоростей прямой и обратной реакций;
4)возможностью подхода к равновесию с двух противоположных сторон;
5)минимальным значением энергии Гиббса dG=0 в изобарно-изотермических процессах и минимальным значением энергии Гельмгольца dF=0 в изохорно-изотермических процессах;
6)неизменностью числа молекул для определенной системы при неизменных внешних условиях.
Впервые зависимость направления химического процесса от концентрации реагирующих веществ установил Н.Н. Бекетов в 1865 г. на основании экспериментов. В математической форме закон был сформулирован Гульдбергом и Вааге в 1867 г.
Рассмотрим кинетический вывод закона действующих масс на примере гомогенной реакции:
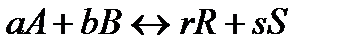
Как известно, скорость прямой реакции пропорциональна произведению концентраций реагентов А и В:
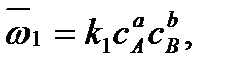
а скорость обратной реакции – произведению концентраций продуктов R и S:
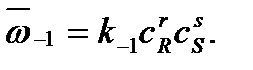
Каждая концентрация возведена в степень, равную стехиометрическому коэффициенту компонента в химическом уравнении. Из условия равенства скоростей прямой и обратной реакций в момент достижения химического равновесия можно записать
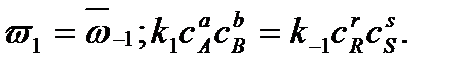
Отношение констант скоростей прямой и обратной реакций называется константой равновесия Кс:
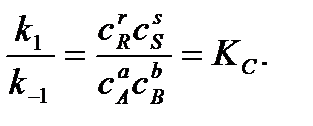
Константа равновесия выражает закон действующих масс:
Изменение концентрации одного из участников реакции вызовет такие изменения концентрации всех остальных таким образом, что Кс сохранит свое числовое значение при неизменности Т и р.
Константа равновесия может быть найдена расчетными и экспериментальными методами. Для расчета используется следующее уравнение:
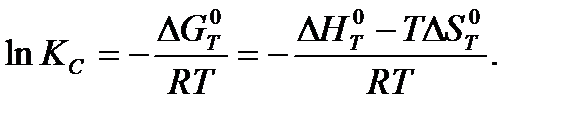
Экспериментальные методы основаны на анализе состава реакционной смеси после достижения состояния химического равновесия.
Зависимость константы равновесия от температуры выражается уравнением изобары Вант-Гоффа:
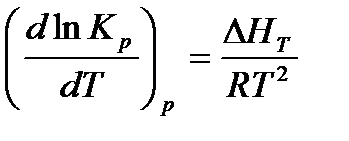
При интегрировании уравнения от Т1 до Т2 и при условии, что ΔНТ в этих пределах остается постоянной, получаем
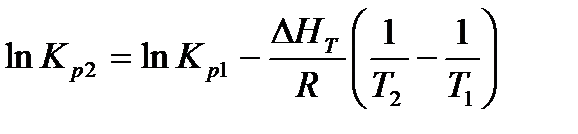
Из этого уравнения следует, что изменение константы равновесия по мере изменения температуры зависит только от знака ΔН. Для эндотермических реакций КР увеличивается с температурой, для экзотермических - уменьшается.
 2015-01-21
2015-01-21 998
998








