1.1 Теория строения органических веществ:
Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них. Так он впервые экспериментально доказал отличие бутана (C4H10) от изобутана (C4H10), несмотря на общую молекулярную формулу. Основные положения теории А. М. Бутлерова заключаются в следующем:
1. В молекулах соединений существует определенный порядок связи атомов, который и носит название строения.
2. Химические свойства соединения определяются составом и строением его молекул.
Для пояснения этих положений можно привести тот факт, что изменение последовательности расположения атомов приводит к образованию нового вещества с новыми свойствами. Например, составу вещества С2Н6О отвечают два разных соединения: диметиловый эфир (СН3–О–СН3) и этиловый спирт (С2Н5ОН).
3. Различное строение при одном и том же составе и молекулярной массе вещества обуславливает явление изомерии.
|
|
|
4. Химический характер атомов, входящих в молекулу, меняется в зависимости от того, с какими атомами они связаны в данной молекуле.
1.2 Виды изомерии.
· Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами. В связи с многообразием органических веществ видов изомерии существует несколько. Вот некоторые из них:
· Изомерия углеродного скелета (структурная изомерия).
В молекуле углеродная цепь может быть линейной, или разветвленной.
Пример: 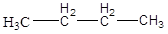 н – бутан (линейная)
н – бутан (линейная)
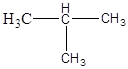
изобутан; 2 метил пропан (разветвленная)
Углеродные атомы, составляющие цепочку в молекулах углеводородов, и их производных могут быть первичными, вторичными, третичными и четвертичными.
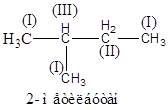 Первичные атомы (I) углерода соединены с одним соседним атомом углерода, вторичные атомы (II) – соответственно с двумя, третичные атомы (III) – с тремя атомами углерода и четвертичные – с четырьмя. В молекуле 2 – метилбутана показаны рассматриваемые атомы углерода.
Первичные атомы (I) углерода соединены с одним соседним атомом углерода, вторичные атомы (II) – соответственно с двумя, третичные атомы (III) – с тремя атомами углерода и четвертичные – с четырьмя. В молекуле 2 – метилбутана показаны рассматриваемые атомы углерода.
· Изомерия положения кратной связи.
Пример:
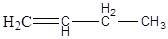
бутен-1,
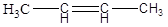 бутен-2.
бутен-2.
· Изомерия гомологических рядов (межвидовая).
Молекулы, относящиеся к разным классам углеводородов, например, алкадиены и алкины имеют одинаковую молекулярную формулу, но различаются по структуре, а, следовательно, и свойствам.
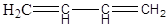 бутадиен 1, 3
бутадиен 1, 3
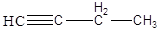 бутин-1.
бутин-1.
· Геометрическая изомерия (пространственная).
Характерна для соединений, имеющих одну или несколько двойных связей. Если рассматривать двойную связь как плоскость, то заместители, располагающиеся у атомов углерода по двойной связи, имеют разное положение по отношению к плоскости двойной связи.
|
|
|
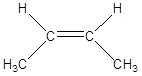
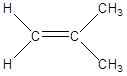
 цис – бутен-2 транс – бутен-2
цис – бутен-2 транс – бутен-2
Так, в молекуле бутена-2 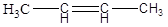 группы СН3 могут находиться либо по одну сторону от плоскости двойной связи в цис –изомере, либо по разные стороны в транс –изомере.
группы СН3 могут находиться либо по одну сторону от плоскости двойной связи в цис –изомере, либо по разные стороны в транс –изомере.
1.3 Классификация органических веществ
Самыми простыми по составу органическими молекулами являются углеводороды, они получили свое название потому, что состоят только из углерода и водорода. Углеводороды являются родоначальниками всех других классов органических соединений.
Классифицируют органические вещества по наличию и порядку соединения атомов в их молекулах. В зависимости от порядка соединения атомов углерода в этой цепи вещества делятся на ациклические, не содержащие замкнутых цепей атомов углерода в молекулах, и карбоциклические, содержащие такие цепи (циклы) в молекулах (см. схему).
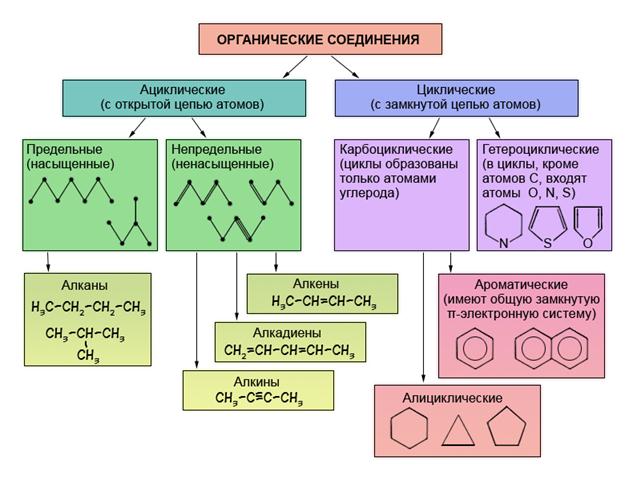
В этом пособии детально будут рассмотрены предельные, непредельные и ароматические углеводороды, т. к. залог понимания всей органической химии лежит в усвоении простых вещей: основных классов органических веществ, закономерностей реакций, протекающих в них. В общем виде свойства рассматриваемых классов веществ, предложены в таблице 1.
Таблица 1
Сводная таблица по классам органических соединений (углеводородов) и их химическим свойствам.
| Предельные углеводороды | непредельные углеводороды | Циклические углеводороды | ||||
| Название класса веществ | алканы | алкены | алкины | алкадиены | циклоалканы | ароматические углеводороды |
| Общая формула | CnH2n+2 | CnH2n | CnH2n-2 | CnH2n-2 | CnH2n | CnH2n-6 |
| Виды связей | одинарная | двойная | тройная | 2 двойных | одинарная | двойная |
| Основные типы реакций и их название | замещение: 1. Hal - галогенирование 2. HNO3 - нитрование | присоединение: 1. Н2 - гидрирование 2. Н2О - гидратация 3. HHal - гидрогалогенирование 4. Hal - галогенирование 5. себе подобных (полимеризация) отщепление: 1. Н2 - дегидрирование 2. Н2О - дегидратация 3. HHal - дегидрогалогенирование | присоединение: 1. Н2 - гидрирование 2. Hal - галогенирование отщепление: 1. Н2 - дегидрирование | присоединение в ароматическом кольце: 1. Н2 - гидрирование 2. Hal - галогенирование замещение в ароматическом кольце: 1. Hal - галогенирование 2. HNO3 –нитрование 3. H2SO4 -сульфирование реакции в боковую цепь: (характерные для типа заместителя) |
1.4 Номенклатура углеводородов.
Номенклатура – это совокупность названий химического соединения. В настоящее время используются 3 вида номенклатуры: тривиальная, рациональная, систематическая (IUPAC - международный союз чистой и прикладной химии).
 2015-02-27
2015-02-27 3138
3138
