При написании электронных конфигураций вначале находим порядковые номера атомов: 26Fe и 24Cr. Атомы находятся в 4-м периоде. Из (5.1) следует, что подуровень 4 s заполняется раньше, чем 3 d. Обычно электронную конфигурацию записывают в порядке заполнения подуровней:
26Fe 1 s 22 s 22 p 63 s 23 p 64 s 23 d 6.
Аналогично записывается «нормальная» электронная конфигурация атома хрома:
24Cr 1 s 22 s 22 p 63 s 23 p 6 4s 2 3d 4.
Электронная оболочка 3d4 близка к устойчивой (d5). Поэтому электронная конфигурация атома Cr с учетом минимизации энергии («проскока электрона») имеет вид:
24Cr 1 s 22 s 22 p 63 s 23 p 6 4s 1 3d 5.
Теперь перейдем к рассмотрению валентной электронной структуры атома железа. Валентная оболочка атома железа заполнена следующим образом:
Fe … 4 s 23 d 6.
Энергетические подуровни 4 s и 3 d символически обозначаются одной s - и пятью d -орбиталями. В соответствии с рядом (5.1) 4 s -подуровень заполняетcя раньше, чем 3 d, поэтому подуровень 4 s располагается ниже, чем 3 d и 4 p:
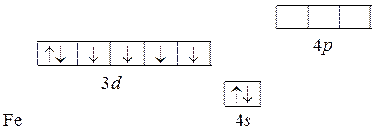
В соответствии с принципом Паули на 4 s -подуровне размещаются два электрона с противоположными спинами. На 3 d -подуровне шесть электронов распределены по правилу Гунда. Здесь неспаренными остаются четыре электрона. Нетрудно записать электронную конфигурацию различных ионов железа, например:
Fe … 3 d 64 s 2, Fe+2… 3 d 54 s 1, Fe+3… 3 d 54 s 0.
Тогда электронная структура иона Fe+3 имеет вид:
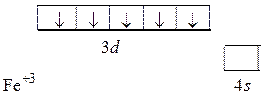
Электронные конфигурации атомов позволяют объяснить периодичность изменения свойств атомов, проявляющихся при их взаимодействии. Периодическая повторяемость свойств атомов по мере роста заряда ядра обусловлена периодической повторяемостью строения внешних электронных оболочек.
Напомним современную формулировку периодического закона: свойства простых веществ, а также свойства их соединений находятся в периодической зависимости от заряда ядра атома.
Графическое отображение периодического закона – периодическая система Д.И. Менделеева. Положение элемента в периодической системе определяется порядковым номером или двумя координатами – номером периода и номером группы. Группы образуют главную (А) и побочную (В) подгруппы. Напомним, что координаты элемента в периодической системе определяют его основные химические свойства: в рамках одного периода с ростом заряда ядра металлические свойства элемента ослабевают и нарастают неметаллические свойства, а в рамках одной группы с ростом числа электронных слоев (номера периода) металлические свойства увеличиваются, соответственно изменяются кислотно-основные свойства оксидов и гидроксидов, а также окислительно-восстановительные свойства атомов и их соединений.
Пример 4. По координатам элемента (4, VА) определите заряд ядра его атома, электронную формулу, валентную конфигурацию атома и его ионов в высшей и низшей степенях окисления.
 2015-02-27
2015-02-27 1576
1576
