Приложение 1
ЛИТЕРАТУРА
NO
Очень разб.
|
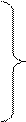 Активный
Активный

 N2
N2
|
 Средней
Средней
HNO3 + Me активности N
активности N
|
 Малоактивный
Малоактивный
разб.
+4
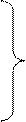 Активный
Активный
NO
+2


Средней
|
 HNO3 + Me
HNO3 + Me активности NO2 + Me(NO3)n + H2O
активности NO2 + Me(NO3)n + H2O
конц. Малоактивный
 NO2
NO2
Примеры:
1. Ba + HNO3 ® NH4NO3 + Ba(NO3)2 + H2O
очень разб.
1  NO
NO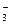 + 10H+ + 8
+ 10H+ + 8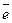 ® NH4+ + 3H2O
® NH4+ + 3H2O
4  Ba – 2
Ba – 2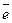 ® Ba2+
® Ba2+
NO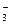 + 10H+ + 4Ba = NH4+ + 3H2O + 4Ba2+
+ 10H+ + 4Ba = NH4+ + 3H2O + 4Ba2+
4Ba + 10HNO3 = NH4NO3 + 4Ba(NO3)2 + 3H2O
2. Zn + HNO3 ® Zn(NO3)2 + N2O + H2O
разб.
 4 Zn – 2
4 Zn – 2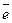 ® Zn2+
® Zn2+
 1 2NO
1 2NO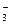 + 10H+ + 8
+ 10H+ + 8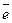 ® N2O + 5H2O
® N2O + 5H2O
4Zn + 2NO3- + 10H+ = 4Zn2+ + N2O + 5H2O
4Zn + 10HNO3 = 4Zn(NO3)2 + N2O + 5H2O
Особенности взаимодействия металлов с концентрированной серной кислотой. Концентрированная серная кислота реагирует со всеми металлами, кроме Ag, Au, Pt. В концентрированной серной кислоте более сильным окислителем, чем катионы водорода, являются сульфат-ионы SO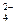 , поэтому при её взаимодействии с металлами Н2 не выделяется, а идёт восстановление серы S+6 в анионе SO
, поэтому при её взаимодействии с металлами Н2 не выделяется, а идёт восстановление серы S+6 в анионе SO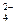 , при этом продукт восстановления зависит от активности металла:
, при этом продукт восстановления зависит от активности металла:
-2
 Активный
Активный

 Средней H2S
Средней H2S
активности
 H2SO4 + Me
H2SO4 + Me S + MeSO4 + H2O
S + MeSO4 + H2O
|
 SO2
SO2
Например,
Zn + H2SO4 ® S + ZnSO4 + H2O
 конц.
конц.
3 Zn – 2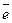 ® Zn2+
® Zn2+
 1 SO
1 SO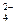 + 8H+ + 6
+ 8H+ + 6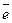 ® S + 4H2O
® S + 4H2O
3Zn + SO42- + 8H+ = 3Zn2+ + S + 4H2O
3Zn + 4H2SO4 = S + 3ZnSO4 + 4H2O
Примечание: в концентрированных растворах НNO3, Н2SO4 такие металлы как Fe, Al, Cr пассивируются образующимися оксидами.
Например,
Fe + HNO3 ® Fe2O3 + NO2 + H2O
конц.
Восстановительные свойства металлов по отношению к катионам металлов. В общем ионно-молекулярном виде такой тип взаимодействия можно представить следующим образом:
Ме1 + Ме2n+ ® Ме1m+ + Ме2
в-ль ок-ль пр. пр.
ок-ия в-ния
Ме1 – m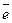 ® Ме1m+
® Ме1m+
Ме2n+ + n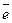 ® Ме2
® Ме2
Е0 = 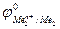 –
– 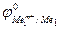
Так как самопроизвольному процессу отвечает Е0 > 0, то 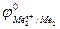 >
> 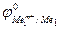 . Это означает, что более активный металл (с меньшим электродным потенциалом, Ме1) вытесняет менее активный металл (с большим электродным потенциалом, Ме2) из раствора его соли.
. Это означает, что более активный металл (с меньшим электродным потенциалом, Ме1) вытесняет менее активный металл (с большим электродным потенциалом, Ме2) из раствора его соли.
Например, реакция омеднения цинка в растворе сульфата меди (II) возможна, т.к. 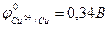 >
> 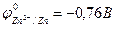 :
:
Zn + CuSO4 = ZnSO4 + Cu.
1. Коровин Н.В. Общая химия. – М.: Высшая школа, 2002. – 558 с.
2. Ахметов Н.С. Общая и неорганическая химия. – М.: Высшая школа, 1998. – 743 с.
3. Хомченко Г.П., Цитович И.К. Неорганическая химия. – М.: Высшая школа, 1987. – 464 с.
4. Глинка Н.Л. Общая химия. – М.: Интеграл-Пресс, 2002. – 702 с.
5. Курс лекций по общей химии / Р.Г. Чувиляев, Л.А. Байдаков, Б.Д. Курников, Л.Н. Блинов. – Л.: Изд-во Ленинградского ун-та, 1989. – 230 с.
6. Кукушкин Ю.Н., Маслов Е.И. Строение атома и химическая связь – Л.: Изд-во Ленинградского университета, 1973. – 79 с.
| Период | Порядковый номер | Элемент | Электронная конфигурация |
| H | 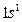
| ||
| He | 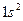
| ||
| Li | 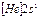
| ||
| Be | 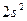
| ||
| B | 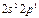
| ||
| C | 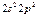
| ||
| N | 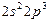
| ||
| O | 
| ||
| F | 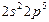
| ||
| Ne | 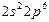
| ||
| Na | 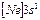
| ||
| Mg | 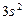
| ||
| Al | 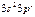
| ||
| Si | 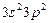
| ||
| P | 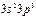
| ||
| S | 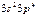
| ||
| Cl | 
| ||
| Ar | 
| ||
| K | 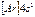
| ||
| Ca | 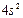
| ||
| Sс | 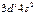
| ||
| Ti | 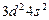
| ||
| V | 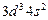
| ||
| Cr | 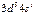
| ||
| Mn | 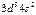
| ||
| Fe | 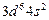
| ||
| Co | 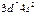
| ||
| Ni | 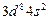
| ||
| Cu | 
| ||
| Zn | 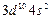
| ||
| Ga | 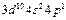
| ||
| Ge | 
| ||
| As | 
| ||
| Se | 
| ||
| Br | 
| ||
| Kr | 
|
Продолжение
| Период | Порядковый номер | Элемент | Электронная конфигурация |
| Rb | 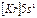
| ||
| Sr | 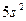
| ||
| Y | 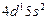
| ||
| Zr | 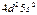
| ||
| Nb | 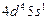
| ||
| Mo | 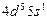
| ||
| Tc | 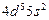
| ||
| Ru | 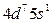
| ||
| Rh | 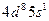
| ||
| Pd | 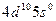
| ||
| Ag | 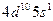
| ||
| Cd | 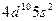
| ||
| In | 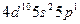
| ||
| Sn | 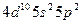
| ||
| Sb | 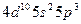
| ||
| Te | 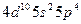
| ||
| I | 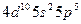
| ||
| Xe | 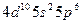
| ||
| Cs | 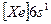
| ||
| Ba | 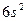
| ||
| La | 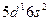
| ||
| Ce | 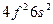
| ||
| Pr | 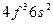
| ||
| Nd | 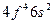
| ||
| Pm | 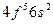
| ||
| Sm | 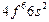
| ||
| Eu | 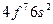
| ||
| Gd | 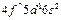
| ||
| Tb | 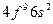
| ||
| Dy | 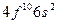
| ||
| Ho | 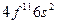
| ||
| Er | 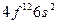
| ||
| Tm | 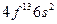
| ||
| Yb | 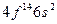
| ||
| Lu | 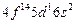
| ||
| Hf | 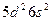
| ||
| Ta | 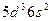
|
Продолжение
| Период | Порядковый номер | Элемент | Электронная конфигурация |
| W | 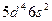
| ||
| Re | 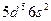
| ||
| Os | 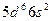
| ||
| Ir | 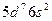
| ||
| Pt | 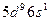
| ||
| Au | 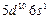
| ||
| Hg | 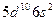
| ||
| Tl | 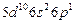
| ||
| Pb | 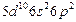
| ||
| Bi | 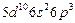
| ||
| Po | 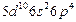
| ||
| At | 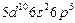
| ||
| Rn | 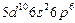
| ||
| Fr | 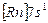
| ||
| Ra | 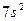
| ||
| Ac | 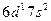
| ||
| Th | 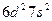
| ||
| Pa | 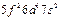
| ||
| U | 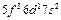
| ||
| Np | 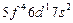
| ||
| Pu | 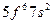
| ||
| Am | 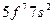
| ||
| Cm | 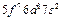
| ||
| Bk | 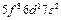
| ||
| Cf | 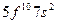
| ||
| Es | 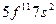
| ||
| Fm | 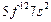
| ||
| Md | 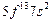
| ||
| (No) | 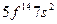
| ||
| (Lr) | 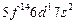
| ||
| (Ku) | 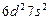
| ||
| (Ns) | 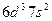
| ||
| Rf | 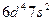
| ||
| Bh | 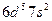
| ||
| Hn | 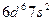
| ||
| Mt | 
|
 2014-02-09
2014-02-09 1018
1018








