Статистика Фе́рми — Дира́ка в статистической физике — квантовая статистика, применяемая к системам тождественных фермионов (как правило, частиц с полуцелым спином, подчиняющихся принципу запрета Паули, то есть, одно и то же квантовое состояние не может занимать более одной частицы); определяет распределение вероятностей нахождения фермионов на энергетических уровнях системы, находящейся в термодинамическом равновесии; предложена в 1926 году итальянским физиком Энрико Ферми и одновременно английским физиком Полем Дираком, который выяснил её квантово-механический смысл; позволяет найти вероятность, с которой фермион занимает данный энергетический уровень.
Работы по статистике Ферми — Дирака были опубликованы в 1926 году, а в 1927 она была применена Арнольдом Зоммерфельдом к электронам в металле.
В статистике Ферми — Дирака среднее число частиц в состоянии с энергией 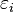 есть
есть
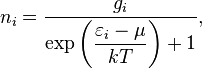
где
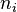 — среднее число частиц в состоянии
— среднее число частиц в состоянии 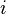 ,
,
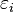 — энергия состояния
— энергия состояния 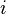 ,
,
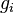 — кратность вырождения состояния
— кратность вырождения состояния 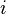 (число состояний с энергией
(число состояний с энергией 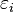 ),
),
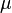 — химический потенциал (который равен энергии Ферми
— химический потенциал (который равен энергии Ферми 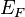 при абсолютном нуле температуры),
при абсолютном нуле температуры),
В (идеальном) ферми-газе в пределе низких температур 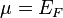 . В этом случае (полагая уровни энергии невырожденными
. В этом случае (полагая уровни энергии невырожденными 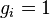 ), функция распределения частиц называется функцией Ферми:
), функция распределения частиц называется функцией Ферми:
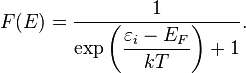
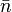 называется распределением Ферми — Дирака. Для фиксированной температуры
называется распределением Ферми — Дирака. Для фиксированной температуры 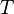 ,
, 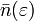 есть вероятность того, что состояние с энергией
есть вероятность того, что состояние с энергией  будет занято фермионом. Обратите внимание, что
будет занято фермионом. Обратите внимание, что 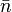 является убывающей функцией от
является убывающей функцией от  . Это соответствует нашим ожиданиям: высокоэнергетические состояния занимаются с меньшей вероятностью.
. Это соответствует нашим ожиданиям: высокоэнергетические состояния занимаются с меньшей вероятностью.
Обратите внимание, что энергетический уровень  имеет вырождение
имеет вырождение 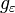 . Теперь можно произвести простую модификацию:
. Теперь можно произвести простую модификацию:
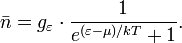 Это число — ожидаемое число частиц, в суммарном состоянии с энергией
Это число — ожидаемое число частиц, в суммарном состоянии с энергией  .
.
Энергия Фе́рми ( 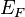 ) системы невзаимодействующих фермионов — это увеличение энергии основного состояния системы при добавлении одной частицы. Это эквивалентно химическому потенциалу системы в ее основном состоянии приабсолютном нуле температур. Энергия Ферми может также интерпретироваться как максимальная энергия фермиона в основном состоянии при абсолютном нуле температур. Энергия Ферми — одно из центральных понятий физики твёрдого тела.
) системы невзаимодействующих фермионов — это увеличение энергии основного состояния системы при добавлении одной частицы. Это эквивалентно химическому потенциалу системы в ее основном состоянии приабсолютном нуле температур. Энергия Ферми может также интерпретироваться как максимальная энергия фермиона в основном состоянии при абсолютном нуле температур. Энергия Ферми — одно из центральных понятий физики твёрдого тела.
При ненулевой температуре ферми-газ не будет являться вырожденным, и населённость уровней будет плавно уменьшаться от нижних уровней к верхним.
В качестве уровня Ферми можно выбрать уровень, заполненный ровно наполовину (то есть вероятность находящегося на искомом уровне состояния быть заполненным частицей должна быть равна 1/2).
Энергия Ферми свободного ферми-газа связана с химическим потенциалом уравнением
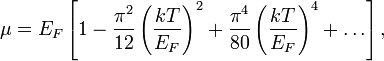
где 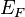 — энергия Ферми,
— энергия Ферми, 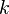 — постоянная Больцмана, и
— постоянная Больцмана, и 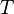 — температура. Следовательно, химический потенциал приблизительно равен энергии Ферми при температурах намного меньше характерной температуры Ферми
— температура. Следовательно, химический потенциал приблизительно равен энергии Ферми при температурах намного меньше характерной температуры Ферми 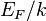 . Характерная температура имеет порядок 105 K для металла, следовательно при комнатной температуре (300 K), энергия Ферми и химический потенциал фактически эквивалентны. Это существенно, потому что химический потенциал не является энергией Ферми, которая входит в распределение Ферми — Дирака.
. Характерная температура имеет порядок 105 K для металла, следовательно при комнатной температуре (300 K), энергия Ферми и химический потенциал фактически эквивалентны. Это существенно, потому что химический потенциал не является энергией Ферми, которая входит в распределение Ферми — Дирака.
13. Идеальный Ферми-газ. Связь энергии Ферми и концентрации электронов. Средняя энергия электрона.
Фе́рми-газ (или идеальный газ Фе́рми — Дира́ка) — газ, состоящий из частиц, удовлетворяющих статистике Ферми — Дирака, имеющих малую массу и высокую концентрацию. Например, электроны в металле. В первом приближении можно считать, что потенциал, действующий на электроны в металле, является постоянной величиной и благодаря сильному экранированию положительно заряженными ионами можно пренебречь электростатическим отталкиванием между электронами. Тогда электроны металла можно рассматривать как идеальный газ Ферми — Дирака.
Вопрос 14. Виды связей атомов и молекул в кристаллах. Аморфное и кристаллическое состояния. Кристаллическая решетка. Период решетки.
В кристаллах имеют место следующие типы связей:
● Ковалентная связь;
● Ионная связь;
● Металлическая связь;
● Молекулярная связь;
● Водородная связь.
Рассмотрим их подробнее.
Ковалентная связь
Нейтральные атомы размещены в узлах кристаллической решётки. Связь образуется направленными валентными электронными облаками.
. Ионная связь
В узлах кристаллической решетки помещаются положительно и отрицательно заряженные ионы. Силы взаимодействия между узлами являются в основном электростатическими (кулоновскими). Связь между такими частицами называется гетерополярной или ионной.
Кристаллы с ионной связью при низких температурах являются диэлектриками. При тепературах близких к температуре плавления они становятся проводниками электричества. Примером кристаллов с ионной решёткой являются кристаллы каменной соли (NaCl).
Металлическая связь
Во всех узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны, отщепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решетка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинут
Молекулярная связь
В узлах кристаллической решетки помещаются определенным образом ориентированные молекулы. Силы связи между молекулами в кристалле имеют ту же природу, что и силы притяжения между молекулами, приводящие к отклонению газов от идеальности. По этой причине их называют вандерваальсовскими силами.
Для кристаллов с молекулярными связями характерны низкие температуры плавления и высокая сжимаемость.
Водородная связь
Водородные связи, образуемые молекулами воды, обусловливают удивительно высокие точки плавления льда и кипения воды, существование максимума плотности воды, расширение воды при замерзании. Многие особые свойства неорганических и органических молекул, например димеризация жирных кислот, объясняются образованием водородных связей. Водородная связь – особенно важная структура белков особенность белков и нуклеиновых кислот.
Молекулярные связи образуют, например, следующие вещества: H2, N2, O2, CO2, H2O.
Аморфное состояние (от греч. а — отрицательная частица и morphē — форма)
твёрдое состояние вещества, обладающее двумя особенностями: его свойства (механические,тепловые, электрические и т. д.) в естественных условиях не зависят от направления в веществе (изотропия);при повышении температуры вещество, размягчаясь, переходит в жидкое состояние постепенно, т. е. в А. с.отсутствует определённая точка плавления.
Эти особенности обусловлены отсутствием в А. с. дальнего порядка — характерной для кристаллов
Кристалическое состояние вещества, характеризуется наличием дальнего порядка в расположении частиц (атомов, ионов, молекул). ВК. с. существует и ближний порядок, к-рый характеризуется постоянными координац. числами, валентнымиуглами и длинами хим. связей. Инвариантность характеристик ближнего порядка в К. с. приводит ксовпадению структурных ячеек при их трансляционном перемещении и образованию трехмернойпериодичности структуры (см. Кристаллохимия. Кристаллы). Вследствие своей макс. упорядоченности К. с.в-ва характеризуется миним. внутр. энергией и является термодинамически равновесным состоянием приданных параметрах -давлении, т-ре, составе (в случае твердых растворов) и др. Строго говоря, полностьюупорядоченное К. с. реально не м. б. осуществлено, приближение к нему имеет место при стремлении т-ры кО К (т. наз. идеальный кристалл). Реальные тела в К. с. всегда содержат нек-рое кол-во дефектов,нарушающих как ближний, так и дальний порядок. Особенно много дефектов наблюдается в твердых р-рах, вк-рых отдельные частицы и их группировки статистически занимают разл. положения в пространстве. Пери́од кристалли́ческой решётки — длина ребра элементарной ячейки кристаллической решётки. Для самой простой идеальной одноатомной кубической решетки это просто расстояние между соседними атомами. В общем случае — это наименьшее расстояние, при сдвиге на которое решетка точно воспроизводит свой исходный вид, то есть в каждом её узле оказываются такие же атомы, что и до сдвига.
Кристалли́ческая решётка — вспомогательный геометрический образ, вводимый для анализа строения кристалла. Решётка имеет сходство с канвой или сеткой, что даёт основание называть точки решётки узлами. Решёткой является совокупность точек, которые возникают из отдельной произвольно выбранной точки кристалла под действием группы трансляции. Это расположение замечательно тем, что относительно каждой точки все остальные расположены совершенно одинаково. Применение к решётке в целом любой из присущих ей трансляций приводит к её параллельному переносу и совмещению. Для удобства анализа обычно точки решётки совмещают с центрами каких-либо атомов из числа входящих в кристалл, либо с элементами симметрии.
ВОПРОС 15 Модель Кронига-Пени. Волновая функция электрона. Энергетические зоны. Классификация кристаллов по структуре энергетических зон. Зона проводимости и валентная зона. Эффективная масса электрона и дырки.
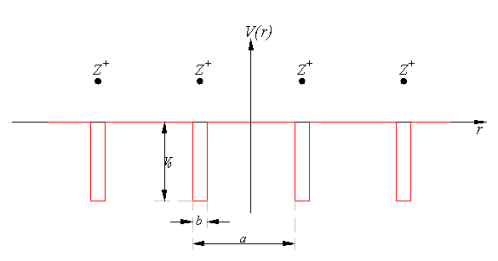 Модель Кронига — Пенни. Волнова́я фу́нкция, или пси-функция
Модель Кронига — Пенни. Волнова́я фу́нкция, или пси-функция 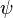 — комплекснозначная функция, используемая в квантовой механике для описания чистого состояния системы. Является коэффициентом разложения вектора состояния по базису (обычно координатному):
— комплекснозначная функция, используемая в квантовой механике для описания чистого состояния системы. Является коэффициентом разложения вектора состояния по базису (обычно координатному):
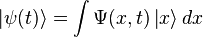
где 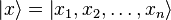 — координатный базисный вектор, а
— координатный базисный вектор, а 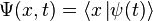 — волновая функция в координатном представлении.
— волновая функция в координатном представлении.
Физический смысл волновой функции заключается в том, что согласно копенгагенской интерпретации квантовой механики плотность вероятности нахождения частицы в данной точке конфигурационного пространства в данный момент времени считается равнойквадрату абсолютного значения волновой функции этого состояния в координатном представлении.
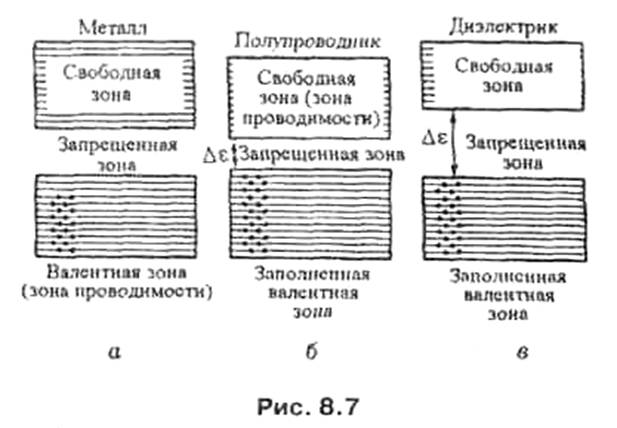
ЭНЕРГЕТИЧЕСКАЯ ЗОНАквазинепрерывная совокупность одночастичных состояний в энергетич. спектре конденсированной среды (вчастности, твёрдого тела). Возникновение зон можно объяснить, рассматривая либо движение частицы впериодич. поле (приближение слабой связи), либо модификацию энергетич. уровней атомов при ихсближении.

Кристаллические структуры делят на гомодесмические (координационные) и гетеродесмические. В первых все атомы соединены одинаковыми химическими связями, образующими пространственный каркас (напр., алмаз, галогениды щелочных металлов). Для вторых характерно наличие структурных фрагментов, внутри которых атомы соединены наиболее прочными (чаще всего ковалентными) связями; атомы, принадлежащие различным фрагментам, связаны существенно слабее. Фрагменты могут представлять собой конечные группировки атомов ("острова"), цепи, слои, каркасы; соотв. выделяют островные, цепочечные, слоистые и каркасные кристаллическая структура Островными кристаллическая структура обладают почти все органические соединения, а также галогены По характеру связи между атомами или структурными фрагментами различают ковалентные кристаллы, ионные кристаллы, металлические кристаллы и ван-дер-ваальсовы кристаллы.
Зона проводимости — в зонной теории твёрдого тела первая из незаполненных электронами зон (диапазонов энергии, где могут находиться электроны) в полупроводниках и диэлектриках. Электроны из валентной зоны, преодолев запрещённую зону, при ненулевой температуре попадают в зону проводимости и начинают участвовать в проводимости, то есть перемещаться под действием электрического поля.
Валентная зона — энергетическая область разрешённых электронных состояний в твёрдом теле, заполненная валентными электронами.
В полупроводниках при T=0 (T — абсолютная температура) валентная зона заполнена электронами целиком, и электроны не дают вклада в электропроводность и другие кинетические эффекты, вызываемые внешними полями. При T>0 К происходит тепловая генерация носителей заряда, в результате которой часть электронов переходит в расположенную выше зону проводимости или на примесные уровни в запрещённой зоне. При этом в валентной зоне образуются дырки, участвующие наряду с электронами в зоне проводимости в переносе электрического тока. Дырки в валентной зоне могут также возникать при нетепловом возбуждении полупроводника — освещении, облучении потоком ионизирующих частиц, воздействии сильного электрического поля, который вызывает лавинный пробойполупроводника, и т. п.
свободный электрон некоторой массы 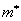 , определяемой соотношением
, определяемой соотношением 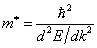 Значение массы
Значение массы 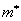 носит название эффективной массы электрона в решетке.
носит название эффективной массы электрона в решетке.
Для свободного электрона, энергия которого определяется как 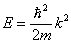 ,
, 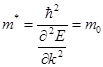 Для дырки mp* > 0, e > 0.
Для дырки mp* > 0, e > 0.
ВОПРОС 16. Определение собственного полупроводника. Возникновение электропроводности собственного полупроводника с точки зрения модельных представлений и зонной теории. Условие электронейтральности. Графики n = f (T), f (Т), Ln f (1/ T) Экспериментальное определение ширины ЗЗ.
Собственный полупроводник или полупроводник i-типа или нелегированный полупроводник (англ. intrinsic — собственный) — это чистый полупроводник, содержание посторонних примесей в котором не превышает 10−8 … 10−9%. Концентрация дырок в нём всегда равна концентрации свободных электронов, так как она определяется не легированием, а собственными свойствами материала, а именно термически возбуждёнными носителями, излучением и собственными дефектами.
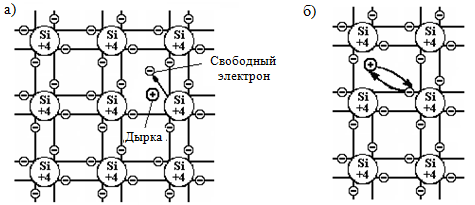
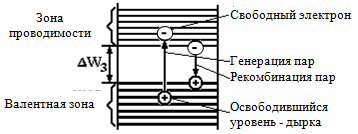 Энергетическая диаграмма, иллюстрирую-щая собственную электропроводность полупроводника при разрушении ковалентной связи
Энергетическая диаграмма, иллюстрирую-щая собственную электропроводность полупроводника при разрушении ковалентной связи
Как во всем кристалле, так и в любом физически малом объеме вещества суммарный заряд всех заряженных частиц должен быть равен нулю—это и есть условие электронейтральности, справедливое для незаряженного в целом тела. 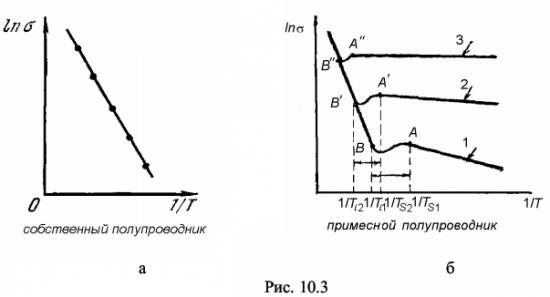
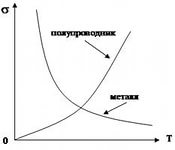
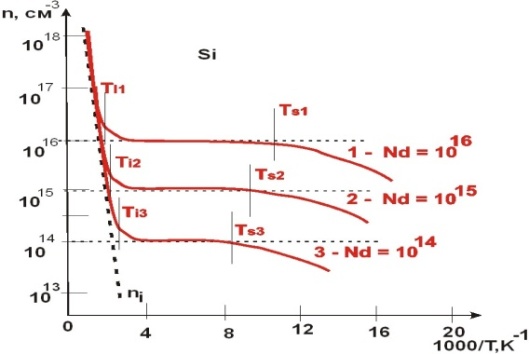
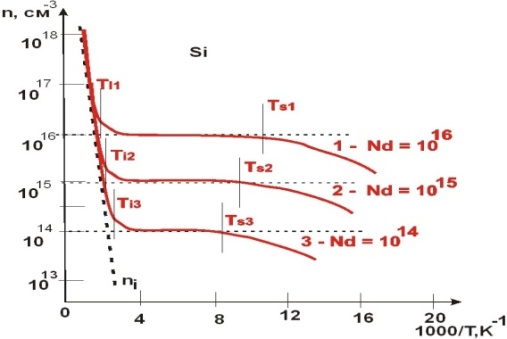
ВОПРОС 17.Определение донорного полупроводника и донорной примеси. Электропроводность донорного полупроводника при высокой и низкой температурах. Температура примесного истощения. Условие электронейтральности. Графики n = f (T), f (Т), Ln f (1/ T). в широком интервале температур.
Примеси, увеличивающие число свободных электронов, называют донорными или просто донорами. ДОНОРНАЯ ПРИМЕСЬ - примесь в полупроводнике, ионизация к-рой приводит к переходу электрона в зону проводимости или на уровень акцепторной примеси.
Температура, при которой F=Ed носит название температуры истощения Ts 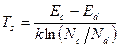 Как во всем кристалле, так и в любом физически малом объеме вещества суммарный заряд всех заряженных частиц должен быть равен нулю—это и есть условие электронейтральности, справедливое для незаряженного в целом тела.
Как во всем кристалле, так и в любом физически малом объеме вещества суммарный заряд всех заряженных частиц должен быть равен нулю—это и есть условие электронейтральности, справедливое для незаряженного в целом тела. 

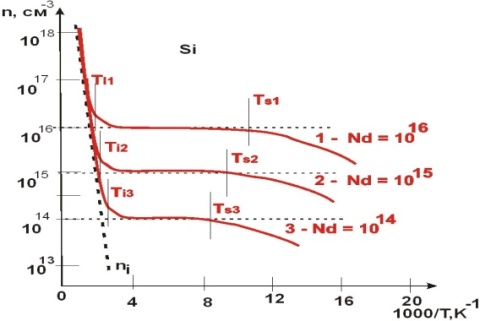
ВОПРОС 18. Определение акцепторного полупроводника и акцепторной примеси. Электропроводность акцепторного полупроводника при высокой и низкой температурах. Температура примесного истощения. Условие электронейтральности. Графики n = f (T), f (Т), Ln f (1/ T) в широком интервале температур.
АКЦЕПТОРНАЯ ПРИМЕСЬ (от лат. acceptor - принимающий) - примесь в полупроводнике, ионизация к-рой сопровождается захватом электронов из валентной зоны или с донорной примеси.В невырожденном акцепторном полупроводнике при температуре абсолютного нуля уровень Ферми лежит посередине между потолком валентной зоны и уровнем акцепторной примеси. При повышении температуры уровень Ферми также стремится к середине запрещенной зоны. В соответствии с положением уровня Ферми концентрация свободных дырок вначале растет по мере ионизации примеси (при этом концентрация свободных электронов пренебрежимо мала).
В акцепторном полупроводнике, как и в случае донорной примеси, при повышении температуры наступает область истощения, характеризующаяся полной ионизацией атомов акцепторной примеси. С дальнейшим ростом температуры уровень Ферми поднимается к середине запрещенной зоны и полупроводник ведет себя как собственный.
Температура, при которой F=Ed носит название температуры истощения Ts 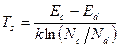 Как во всем кристалле, так и в любом физически малом объеме вещества суммарный заряд всех заряженных частиц должен быть равен нулю—это и есть условие электронейтральности, справедливое для незаряженного в целом тела.
Как во всем кристалле, так и в любом физически малом объеме вещества суммарный заряд всех заряженных частиц должен быть равен нулю—это и есть условие электронейтральности, справедливое для незаряженного в целом тела. 

 2015-02-27
2015-02-27 4573
4573
