Свойства элементов находятся в периодической зависимости от величины заряда ядер их атомов. Среди важнейших свойств атомов можно выделить следующие:
· радиусы атомов: с ростом заряда ядер в периодах уменьшаются; с ростом заряда ядер в группах увеличиваются в особенности в главных подгруппах;
· электроотрицательность (ЭО) – способность атомов притягивать пару электронов, обобществляемых при образовании химической связи. ЭО элементов возрастает по диагонали периодической системы: минимальная ЭО – у атомов Cs (0,79 по шкале Полинга), у атомов F – максимальная ЭО (4,0). Количественно ЭО характеризуется потенциалом ионизации I и его сродством к электрону Еср.;
· энергия ионизации (I) – энергия, которая необходима для удаления электрона из атома, иона или молекулы в газовой фазе без передачи освобожденному электрону кинетической энергии: М(г) = М(г)+ + 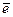 . Отрыву каждого электрона в атоме соответствует определенный потенциал ионизации. Последующий потенциал ионизации всегда больше, чем предыдущий, т.к. труднее оторвать отрицательный электрон от более положительно заряженного иона. Рост потенциала в периодах объясняется увеличением заряда ядер атомов и усилением притяжения к ним электронов (рост неметалличности); а уменьшение потенциалов в группах – увеличением размеров атомов и ослаблением притяжения ядрами внешних электронов (рост металличности);
. Отрыву каждого электрона в атоме соответствует определенный потенциал ионизации. Последующий потенциал ионизации всегда больше, чем предыдущий, т.к. труднее оторвать отрицательный электрон от более положительно заряженного иона. Рост потенциала в периодах объясняется увеличением заряда ядер атомов и усилением притяжения к ним электронов (рост неметалличности); а уменьшение потенциалов в группах – увеличением размеров атомов и ослаблением притяжения ядрами внешних электронов (рост металличности);
· сродство к электрону (Е) - энергия, которая выделяется или поглощается в результате присоединения электрона к нейтральному атому или к отрицательно заряженному иону: М(г) + 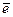 = М(г)-. Сродство к электрону с ростом заряда ядер и уменьшением размеров атомов (ионов) в периодах увеличивается, а с ростом заряда ядер и размера атомов (ионов) в группах уменьшается.
= М(г)-. Сродство к электрону с ростом заряда ядер и уменьшением размеров атомов (ионов) в периодах увеличивается, а с ростом заряда ядер и размера атомов (ионов) в группах уменьшается.
 2015-02-27
2015-02-27 421
421








