1. Учтите биохимическую активность микроорганизмов. Заполните таблицу.
Таблица
Биохимическая активность бактерий
| Морфология бакте-рий | Окраска по Граму | Биохимические свойства | Вид культуры | |||||||
| Сахаролитические ферменты | Протеолитические ферменты | |||||||||
| Глюкоза | Лактоза | Сахаро-за | Маль-тоза | Манит | Желатин | Индол | Серо-водород |
2. Приготовьте препараты из культуры анаэробов на среде Китта-Тароцци и молоке под маслом.
Приготовление мазков из культуры анаэробов со среды Китта-Тароцци и молока под маслом имеет свои особенности. Пробирку со средой наклоните под углом 30-35 градусов. Возьмите стерильную пастеровскую пипетку, закройте указательным пальцем с тупого конца и отпустите под слой вазелинового масла в нижнюю часть среды, после чего откройте пипетку, сняв с нее палец. Поднявшейся по капилляру жидкости будет достаточно для приготовления мазка. Не меняя наклона пробирки, выведите капилляр из среды. Мазок сделайте обычным способом. Окрасьте по Граму.
3. Приготовление мазков из кислого молока и квашенной капусты проведите обычным способом. Окрасьте по методу Грама. При микроскопии мазков обратите внимание на размер, форму бактерий и их окраску. Изучите, сделайте зарисовки в альбом.
4. Произведите посев почвенной суспензии на среду Китта-Тароцци и молоко под маслом.
Для этого наберите в пастеровскую пипетку 0,2-0,5 мл почвенной суспензии и внесите ее в пробирку со средой Китта-Тароцци (среда накопления), поместите в термостат на 18-24 час при 37ºС. Учтите на следующем занятии изменения, происшедшие в среде, а именно: помутнение, газообразование. Оформите протокол.
Тема: Культивирование вирусов
Цель: ознакомление с методами культивирования вирусов
Вопросы для самоподготовки
1. Охарактеризовать возможные типы взаимодействия вирусов с клетками.
2. Дать понятие о репродукции вирусов.
3. Этапы репродукции вирусов.
4. Привести примеры интегративного взаимодействия вирусов и клеток.
5. Дать понятие состояния вирогении.
6. Вирусы, как облигатные паразиты, способы их культивирования.
7. Культивирование вирусов на лабораторных животных.
8. Куриные эмбрионы в культивировании вирусов.
9. Культивирование вирусов в клеточных культурах.
Литература
1. Дикий И.Л., Холупяк И.Ю., Шевелева Н.Е., Стегний М.Ю. Микробиология. – Х.: Прапор, Издательство УкрФА, 1999. – С. 66-67.
2. Н.П.Елинов, Н.А.Заикина, И.П.Соколова. Руководство к лабораторным занятиям по микробиологии. – М.: Медицина, 1988. – С. 53-56.
Вирусы, будучи своеобразной формой жизни, лишены собственного метаболизма и белоксинтезирующих систем не размножаются на искусственных питательных средах. Их средой обитания являются клетки хозяина – от прокариотической бактериальной клетки до многоклеточного организма.
Поэтому для культивирования вирусов применяют лабораторных животных, куриные эмбрионы, клеточные культуры.
Большинство вирусов могут быть дифференцированы друг от друга на основании патогенности для различных видов животных (например арбовирусы). Некоторые вирусы не представляется возможным культивировать ни в куриных эмбрионах, ни в культурах клеток, а только в организме восприимчивых животных.
Наиболее часто в вирусологических исследованиях используют белых мышей, крысят, морских свинок, собак, кошек. Иногда для опытов берут кур, уток, голубей, свиней, телят, овец, лошадей.
Отбирают здоровых животных одинакового возраста, веса, пола, упитанности. Затем животных маркируют с помощью красителей (пикриновой кислоты) или выстриганием шерсти, татуировки уха, нумерованных бирок и др.
Заражение производится наиболее эффективным для данного вируса методом.
Например для нейротропных вирусов (бешенства) лучшим является внутримозговое введение инфицированного материала при работе с пневмотропными вирусами (грипп) производится заражение в нос, или интратрахеально. Иногда подопытных животных заражают нанесением инфицированного материала на роговицу глаза или введением в семенники. Если при первичном заражении лабораторные животные не заболевают, необходимо провести 2-3 последовательных слепых пассажа. Для этого через 5-7 дней после заражения животных убивают, взятым от них материалом заражают следующую партию животных, от которых вновь отбирают материал для очередного заражения.
Лабораторные животные используются для идентификации вируса в РН, изучения биологических свойств вируса (инфекционности, иммуногенности), определения эффективности противовирусных препаратов.
В связи с тем, что подопытные животные часто являются латентными вирусоносителями в настоящее время все шире применяются в вирусологических исследованиях безмикробные животные – гнотобионты.
Гнотобионты являются уникальной моделью для выяснения значения нормальной микрофлоры в жизнедеятельности организма, изучения различных вопросов иммунитета, а также широко используются в биологической промышленности при изготовлении специфических гипериммунных сывороток.
Безмикробные животные более чувствительны к вирусным инфекциям, чем обычные. Особое положение среди гнотобионтов занимают СПФ-лабораторные животные (Spezifisch pathogenfrei) свободные от патогенных микроорганизмов. В их организме присутствует нормальная микрофлора.
В настоящее время получены СПФ-крысы, мыши, морские свинки, поросята и СПФ-птицы.
Применение данного метода культивирования вирусов ограничивается из-за невосприимчивости животных ко многим вирусам человека.
Широко используют для культивирования вирусов куринные эмбрионы с целью индикации вируса в РГА, определения инфекционного титра вируса, постановки реакции нейтрализации, для получения антигенов, вакцин и т.д.
В куриных эмбрионах могут размножаться вирусы с различным тропизмом, так как здесь имеются четыре субстрата для вируса; амнион, аллантоис, хорионаллантоисная мембрана и желточный мешок. Начиная с 4-5 дня куриный эмбрион (КЭ) становится хорошо различимым при просмотре под овоскопом. При овоскопии яйца отмечают карандашом не скорлупе границы воздушного мешка, положение эмбриона, желточного мешка, намечают межсосудистый участок треугольной формы размером 5х5 мм. Эти отметки служат ориентиром при заражении.
Выбор метода заражения куриных эмбрионов зависит от биологических свойств исследуемого вируса.
Заражение на харионаллантоисную оболочку производят при работе с дермотропными, нейротропными вирусами (оспы, осповакцины, герпеса и др.). Используют 10-12 дневные куриные эмбрионы с хорошо сформированной оболочкой, инкубированные в горизонтальном положении. Поверхность яйца над воздушным мешком и боковую поверхность с той стороны, где будет проводиться заражение, дезинфицируют спиртом, прожигают огнем, смазывают 2% раствором йода, повторно прожигают. На скорлупе яйца, напротив отмеченного бессосудистого участка выпиливают равнобедренный треугольник со сторонами 5-6 мм. Работу проводят осторожно, чтобы не повредить хорионаллантоисную оболочку. Треугольник вынимают пинцетом и помещают рядом с отверстием. Иглой надрывают подскорлупную оболочку. На обнаженную хорионаллантоисную оболочку пастеровской пипеткой наносят 0,1 мл вируссодержащего материала. Одновременно в центре тупого конца яйца просверливают отверстие и через него резиновым баллончиком отсасывают воздух в результате чего хорионаллантоисная оболочка отслаивается и на неё попадает вируссодержащий материал. Треугольник берут пинцетом, слегка обжигают и помещают на свое место. Оба отверстия на скорлупе закрывают парафином или медицинским лейкопластырем. Яйцо осторожно покачивают для распределения материала по поверхности оболочки. Инкубируют в горизонтальном положении при 35ºС в течение 2-3 суток. Через 24 часа проводят контроль на патогенное действие, для чего зараженные яйца просматривают на овоскопе и с погибшими зародышами – выбрасывают.
Как правило, при заражении дермотропными вирусами гибели КЭ не наблюдается. Показателем размножения вирусов является наличие поражений в виде непрозрачных беловатых бляшек различной формы, которые представляют собой очаги пролиферации оболочки с некротическим центром в поздней стадии.
Чтобы получить вирус, яйца выдерживают 12-18 часов при 4ºС. Вскрытие эмбрионов производят в стерильных боксах. Яйцо помещают в чашку Петри на ватную подставку, смазанную дезинфицирующим раствором. Поверхность скорлупы дезинфицируют. Скорлупу разрезают ножницами и удаляют по нижней границе воздушной полости не нарушая целостности подскорлуповой и хорионаллантоисной оболочек. Затем стерильным пинцетом осторожно снимают подскорлупную оболочку, разрезают хорионаллантоисную оболочку, удаляют эмбрион, желточный мешок и белок. Извлекают пинцетом хорионаллантоисную оболочку, отслаивают от внутренней поверхности скорлупы и переносят в стерильную чашку Петри с 2-3 мл физиологического раствора. До проведения дальнейших исследований хорионаллантоисную оболочку можно хранить при -30- -70ºС.
Заражение в аллантоисную полость производят при гриппе, парагриппе и др.
Основным методом культивирования вируса при этом является заражение 9-12 дневных куриных эмбрионов, когда аллантоисной жидкости содержится больше всего.
Поверхность скорлупы яйца над воздушным мешком, где будет производиться заражение, дезинфицируют 70% раствором спирта, прожигают огнем, смазывают 2% раствором йода, повторно прожигают. Яйцо помещают вертикально, тупым концом вверх. Над центром воздушного мешка делают прокол скорлупы. В шприц набирают 0,2 мл. вирусного материала. Вводят в отверстие иглу шприца. Прокалывают хорионаллантоисную оболочку и погружают иглу в аллантоисную полость. От поверхности скорлупы иглу вводят на глубину 1,5 см. Вводят 0,2 мл вирусного материала. Место инъекции протирают йодом, отверстие заклеивают лейкопластырем или заливают парафином.
После 72 часов инкубации в вертикальном положении при 35ºС яйца выдерживают при 4ºС в течение 12-18 часов для остановки крови в сосудах. Затем стерильными ножницами срезают скорлупу по границе воздушной полости. Подскорлупную и хорионаллантоисную оболочки разрезают и отгибают на края скорлупы. Яйцо слегка наклоняют и шприцом емкостью 10 мл отсасывают аллантоисную жидкость. Из одного яйца отбирают 6-8 мл. жидкости. Показателем размножения гемаглютинирующих вирусов является РГА, идентификацию осуществляют в РСК, а также заражением аллантоисной жидкостью восприимчивых животных и культур клеток.
Заражение в амниотическую полость производят главным образом для выделения вирусов из первичного патологического материала при ОРЗ и гриппе.
Заражение в желточный мешок используется для культивирования вирусов орнитоза, лимфогранулемы и трахомы. Используют 5-6 дневные эмбрионы, так как в это время желточный мешок имеет большой объем, что обеспечивает большую клеточную поверхность для размножения вируса. Скорлупу над воздушным мешком дезинфицируют, делают в ней отверстие; иглу (длина 5 см диаметр 0,5 мм) вводят вертикально до упора. Количество вирусного материала при заражении в желток составляет 0,3-0,5 мл, больше чем при других методах введения. Затем иглу быстро вынимают, место введения дезинфицируют и закрывают лейкопластырем или парафином.
После инкубации при 35ºС в течение 72 часов и охлаждения при 4ºС 12-18 часов скорлупу вскрывают по нижнему краю воздушного мешка, разрушают подскорлупную и хорионаллантоисную оболочки, желточный мешок отсекают от эмбриона, разрезают, чтобы вышел желток. Оболочки, освобожденные от желтка промывают в стерильном физиологическом растворе. Проводят контроль на бактериологическую стерильность и наличие вируса. Хранят желточные оболочки при температуре -30- -70ºС.
К недостаткам данного метода культивирования вирусов относятся невозможность обнаружения исследуемого вируса без предварительного вскрытия эмбриона, а также наличие в нем большого количества белков и других соединений, затрудняющих последующую очистку вирусов при изготовлении иммунобиологических препаратов.
В настоящее время ни одна вирусологическая лаборатория не обходится без культур клеток, играющих важную роль в диагностических исследованиях. Клеточные культуры используются как для выделения вирусов из патологического материала, определения титра вируса, при изготовлении вирусных антигенов для вакцин и серологических реакций.
Культура тканей – это более широкое понятие, чем культура клеток.
Наиболее распространено культивирование клеток в монослое на стенках сосудов.
Культуры клеток готовят из тканей животных или человека в стерильных условиях. Первичные клеточные культуры можно получать также из эмбриональных тканей человека, эмбрионов мышей, новорожденных крольчат и т.д.
Для диспергирования ткани чаще всего используют 0,3% раствор трипсина. Трипсин разрушает межклеточное белковое вещество. Существует несколько вариантов трипсинизации различных тканей для приготовления первичной клеточной культуры. Разберем конкретный пример трипсинизации почек методом многократной экстракции для получения первичной клеточной культуры почки теленка.
|

 К измельченной и 3 раза промытой раствором Хэнкса почечной ткани добавляют 50 мл 0,3% теплого раствора трипсина и перемешивают на магнитной мешалке в течение 5 минут. Надосадочную жидкость сливают и выбрасывают. Ткань заливают новой порцией трипсина в количестве 50-100 мл, перемешивают с помощью магнитной мешалки 20 мин. при комнатной температуре. Затем полученную суспензию клеток помещают в центрифужный стакан и центрифугируют 20 мин. при 600 об/мин. Осадок промывают раствором Хэнкса двукратно с последующим центрифугированием 20 мин. при 600 об/мин. Полученные клетки ресуспендируют в небольшом объеме среды 199 с 10% сыворотки КРС и хранят на льду до смешивания с клетками последующих экстракций. Экстракцию проводят 3-4 раза до полного истощения ткани. Суспензию клеток, полученную при всех экстракциях смешивают, фильтруют через марлевый фильтр в центрифужный стакан, центрифугируют 15 минут при 800 об/мин. Надосадочную жидкость выбрасывают. Клетки ресуспендируют в 50 мл. ростовой среды, контролируют на стерильность путем посева 0,1 мл в 2 пробирки с МПБ и МПА, проводят подсчет клеток в камере Горяева. Для чего после тщательного взбалтывания клеток берут 2 пробы по 0,5 мл 0,1%-го раствора кристаллвиолета в 0,1 н. растворе лимонной кислоты. Перемешивают суспензию и подсчитывают число сохранных клеток. Количество клеток, содержащихся в 1 мл. вычисляют по формуле:
К измельченной и 3 раза промытой раствором Хэнкса почечной ткани добавляют 50 мл 0,3% теплого раствора трипсина и перемешивают на магнитной мешалке в течение 5 минут. Надосадочную жидкость сливают и выбрасывают. Ткань заливают новой порцией трипсина в количестве 50-100 мл, перемешивают с помощью магнитной мешалки 20 мин. при комнатной температуре. Затем полученную суспензию клеток помещают в центрифужный стакан и центрифугируют 20 мин. при 600 об/мин. Осадок промывают раствором Хэнкса двукратно с последующим центрифугированием 20 мин. при 600 об/мин. Полученные клетки ресуспендируют в небольшом объеме среды 199 с 10% сыворотки КРС и хранят на льду до смешивания с клетками последующих экстракций. Экстракцию проводят 3-4 раза до полного истощения ткани. Суспензию клеток, полученную при всех экстракциях смешивают, фильтруют через марлевый фильтр в центрифужный стакан, центрифугируют 15 минут при 800 об/мин. Надосадочную жидкость выбрасывают. Клетки ресуспендируют в 50 мл. ростовой среды, контролируют на стерильность путем посева 0,1 мл в 2 пробирки с МПБ и МПА, проводят подсчет клеток в камере Горяева. Для чего после тщательного взбалтывания клеток берут 2 пробы по 0,5 мл 0,1%-го раствора кристаллвиолета в 0,1 н. растворе лимонной кислоты. Перемешивают суспензию и подсчитывают число сохранных клеток. Количество клеток, содержащихся в 1 мл. вычисляют по формуле:
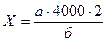 ,
,
где Х – количество клеток в 1 мл;
а – среднее количество клеток в малом квадрате;
б – количество сосчитанных малых квадратов;
4000 – число малых квадратов в кубическом миллиметре;
2 – коэффициент разведения суспензии добавленным объемом краски.
После подсчета клеток суспензии добавляют такое количество питательной среды, чтобы в 1 мл. содержалось необходимое количество клеток: 200-40000 и более. Для культивирования в каждую пробирку засевают 0,5-1 мл суспензии. Пробирки плотно закрывают стерильными резиновыми пробками и помещают в штативы. Клетки прикрепляются к внутренней поверхности пробирки и через 3-7 суток образуют клеточный монослой, который уже сможет быть использован для культивирования вирусов. Для заражения 3-5 пробирок с культурой клеток необходимо 0,5 мл вируссодержащего материала. Ростовую среду удаляют и вносят по 0,1 мл вируссодержащей суспензии на клеточный монослой. Вирус оставляют на клетках в течение 1-2 часов для адсорбции при комнатной температуре, после чего неадсорбировавшийся вирус удаляют, а монослой заливают питательной средой 199 и инкубируют при 37°С. О репродукции вирусов в клеточной культуре судят по цитопатическому действию (ЦПД), которое обнаруживают при микроскопии зараженных вирусом клеточных культур. При этом часть клеток погибает и отслаивается от стенки пробирки. Вирионы, освобождающиеся при разрушении одних клеток заражают другие, которые впоследствии также погибают, в результате чего от сплошного клеточного монослоя остаются отдельные участки клеток.
При репродукции одних вирусов (парамиксовирусы, герпесвирусы) ЦПД проявляется в виде синцития, образовавшегося в результате слияния клеток; у энтеровирусов и реовирусов – в виде сморщивания и деструкции клеток; у аденовирусов – в виде агрегации клеток в группы и грозди и т.д.
ЦПД вирусов оценивают в динамике, просматривая инфицированную культуру клеток под микроскопом в разные сроки после ее заражения вируссодержащим материалом. По характеру ЦПД и срокам его проявления судят о наличии того или иного вида вируса в процессе его ориентировочной идентификации.
Количество вирусных частиц определяют методом титрования по ЦПД в клеточных культурах, для чего их заражают десятикратными разведениями вируса. Затем просматривают на наличие ЦПД. Титром вируса считают наибольшее разведение, вызывающее ЦПД у 50% зараженных культур. Титр вируса выражают количеством тканевых цитопатических доз ТЦД50/мл.
Другим количественным методом учета вирусных частиц является метод бляшек. В этом случае культуру клеток после инфицирования вируссодержащим материалом покрывают тонким слоем агара. После инкубирования посевов в течение нескольких суток на агаровом покрытии появляются прозрачные участки погибших клеток в сплошном монослое клеточной культуры. Каждый такой участок или бляшка образуется при размножении одной вирусной частицы и хорошо заметна на красном фоне клеток прижизненно окрашенных нейтральным красным. В этом случае титр вируса выражают числом бляшкообразующих единиц (БОЕ) в 1 мл. Причем размеры, форма и сроки появления бляшек отличаются как у отдельных видов вирусов, так и у штаммов одного вида.
Некоторые виды вирусов можно обнаружить и идентифицировать по включениям, которые они образуют в ядре или цитоплазме инфицированных клеток. Вирусные включения представляют собой или реакцию клетки на присутствие вируса или места скопления вирусных частиц, которые могут быть выявлены в препаратах, приготовленных из зараженной ткани и окрашенных по Романовскому-Гимза или с помощью флуорохромов. В данном случае используют люминесцентную микроскопию.
 2015-02-27
2015-02-27 564
564








