Основная задача современной физической химии – выявление детального механизмах явлений, изучение и объяснение основных закономерностей, определяющих направление химических процессов, скорости их протекания, влияния на них среды, примесей, излучения и других внешних факторов, установление связи между строением вещества и его реакционной способностью.


 ФИЗИЧЕСКАЯ ХИМИЯ
ФИЗИЧЕСКАЯ ХИМИЯ
строение химическая учение о химическая электрохимия
вещества термодинамика растворах кинетика и катализ
фазовые равновесия фотохимия
Термодинамика изучает наиболее общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия и процессы перехода между этими состояниями.
Система – это рассматриваемая часть материальной вселенной, отделенная от окружающей среды замкнутой поверхностью – границей.
1. В зависимости от наличия или отсутствия обмена теплом и веществом с внешней средой:
а) открытые системы – способны обмениваться с окружающей средой энергией и веществом (колба с раствором, из которой испаряется растворитель, она может нагреваться и остывать)
|
|
|
б) Закрытая система – может обмениваться с окружающей средой только энергией (плотно закрытая колба, но она может нагреваться и остывать)
в) Изолированная система – отсутствует обмен с окружающей средой и веществом и энергией.
Открытые и закрытые системы могут претерпевать изменения передача теплоты от более нагретой части к менее нагретой, взаимные превращения энергии, выравнивание концентраций), при которых могут изменяться как сами системы, так и окружающая среда. Внутри изолированной системы любые превращения не изменяют ее внутренней энергии и не вызывают изменений окружающей среды.
2. В зависимости от количества, дисперстности, агрегатного состояния, наличие поверхности раздела различают гомогенные, гетерогенные, одно-, двух-, трехфазные, одно-, двух-, трехкомпонентные системы.
а) Гомогенные системы – в них отсутствуют поверхности раздела между отдельными частями (фазами) системы (смесь газов, истинные растворы).
б) Гетерогенные системы – состоят из двух или большего числа частей отделенных друг от друга поверхностью раздела (речной песок в воде, вода + лед + пар).
Фаза – однородная часть системы, ограниченная поверхностью раздела. Различают: газовую (г), жидкую (ж) и твердую (т) фазы.
Компоненты – минимальное количество веществ, из которых может быть составлена система
Например:
вода (г), вода (т). вода (ж) – однофазные, однокомпонентные, гомогенные системы.
вода (г)+ вода (т)+ вода (ж) – трехфазная, однокомпонентная, гетерогенная система.
|
|
|
карбонат кальция(т)+оксид кальция(т)+углекислый газ (г) – двухфазная, однокомпонентная, гетерогенная система.
раствор хлорида натрия в воде – однофазная, двухкомпонентная, гомогенная система.
Термодинамические величины, определяющие состояние системы, называют термодинамическими параметрами.
Обычно параметры – это физические величины, которые поддаются непосредственному измерению (температура, давление, объем).
Те параметры, которые полностью определяют состояние системы, называют параметрами состояния. Например, состояние идеального газа описывают двумя термодинамическими параметрами (температура, давление). Параметры разделяют на интенсивные и экстенсивные.
Экстенсивные – те величины, которые зависят от количества вещества системы (объем, масса, энтропия и т.д.).
Интенсивные – их значения не зависят от количества вещества системы (температура, давление).
Переход термодинамической системы из одного состояния в другое называется процессом. При любом процессе одни параметры системы остаются неизменными, другие изменяются. В зависимости от того, какие параметры при переходе остаются постоянными различают процессы: изотермический (const t), изобарический (const р), изохорический (const V), изобарно-изотермический (const t, р), изохорно-изотермический (const V, t).
Процессы связанные с теплообменом.
1. Адиабатический – в изолированной системе при отсутствии обмена с внешней средой.
2. Экзотермический – протекает с выделением тепла.
3. Эндотермический – протекает с поглощением тепла.
В термодинамических системах могут протекать необратимые и обратимые процессы.
Обратимый процесс – процесс, при котором возможен переход системы к исходному состоянию без каких-либо изменений в самой системе и в окружающей среде.
Необратимые – процессы, при которых система переходит в новое состояние с полным исчезновением исходных веществ.
Для более полного описания состояния системы дополнительно вводят функции состояния. Их значение зависит только от параметров состояния и не зависит от пути перехода системы из одного состояния в другое.
Основные функции состояния:
П – потенциальная энергия; U – внутренняя энергия; К – кинетическая энергия; Е – полная энергия; Н – энтальпия; S – энтропия; G – энергия Гиббса; F – энергия Гельмгольца.
Любая система характеризуется определенным запасом энергии.
Е=К+П+ U U=Е-К-П U=К+П
К – энергия движения всей системы как целого
П – энергия обусловленная положением системы в пространстве
U – включает энергию движения и взаимодействия всех частиц, входящих в данную систему. Внутренняя энергия складывается из кинетической и потенциальной. Обычно внутреннюю энергию относят к 1 молю вещества и называют молярной внутренней энергией (Дж/моль).
Между системой и окружающей средой осуществляется обмен энергией: механической, тепловой, электрической и др. Они могут прямо или косвенно превращаться друг в друга. Обычно рассматривают превращение механической энергии - в тепловую. Единица измерения тепловой энергии в системе СИ Дж (1кал= 4,18 Дж).
Принято количество отданной системой энергии обозначать знаком «-», принятой «+». Т.е. + Q – система получила тепловую энергию, - Q система отдала тепловую энергию.
Лекция 2 «Твердое и жидкое состояние вещества».
Растворимость газов в газах
Газообразное состояние вещества характеризуется слабым взаимодействием между частицами и большими расстояниями между ними. Поэтому газы смешиваются в любых соотношениях (при очень высоких давлениях, когда плотность газов приближается к плотности жидкостей, может наблюдаться ограниченная растворимость). Газовые смеси описываются законом Дальтона:
Общее давление газовой смеси равно сумме парциальных давлений всех входящих в неё газов.
|
|
|
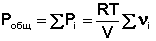
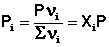
Растворимость газов в жидкостях
Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ (особенно сильно влияет на растворимость газов концентрация электролитов).
Наибольшее влияние на растворимость газов в жидкостях оказывает природа веществ. Так, в 1 литре воды при t = 18 °С и P = 1 атм. растворяется 0.017 л. азота, 748.8 л. аммиака или 427.8 л. хлороводорода. Аномально высокая растворимость газов в жидкостях обычно обусловливается их специфическим взаимодействием с растворителем – образованием химического соединения (для аммиака) или диссоциацией в растворе на ионы (для хлороводорода). Газы, молекулы которых неполярны, растворяются, как правило, лучше в неполярных жидкостях – и наоборот. Зависимость растворимости газов от давления выражается законом Генри – Дальтона:
Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью.
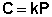
Здесь С – концентрация раствора газа в жидкости, k – коэффициент пропорциональности, зависящий от природы газа. Закон Генри – Дальтона справедлив только для разбавленных растворов при малых давлениях, когда газы можно считать идеальными. Газы, способные к специфическому взаимодействию с растворителем, данному закону не подчиняются.
Растворимость газов в жидкостях существенно зависит от температуры; количественно данная зависимость определяется уравнением Клапейрона – Клаузиуса (здесь X – мольная доля газа в растворе, λ – тепловой эффект растворения 1 моля газа в его насыщенном растворе):
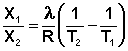
Как правило, при растворении газа в жидкости выделяется теплота (λ < 0), поэтому с повышением температуры растворимость уменьшается. Растворимость газов в жидкости сильно зависит от концентрации других растворенных веществ. Зависимость растворимости газов от концентрации электролитов в жидкости выражается формулой Сеченова (X и Xo – растворимость газа в чистом растворителе и растворе электролита с концентрацией C):
|
|
|
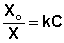
Взаимная растворимость жидкостей
В зависимости от природы жидкости могут смешиваться в любых соотношениях (в этом случае говорят о неограниченной взаимной растворимости), быть практически нерастворимыми друг в друге либо обладать ограниченной растворимостью. Рассмотрим последний случай на примере системы анилин – вода. Если смешать примерно равные количества воды и анилина, система будет состоять из двух слоев жидкости; верхний слой – раствор анилина в воде, нижний – раствор воды в анилине. Для каждой температуры оба раствора имеют строго определенный равновесный состав, не зависящий от количества каждого из компонентов.
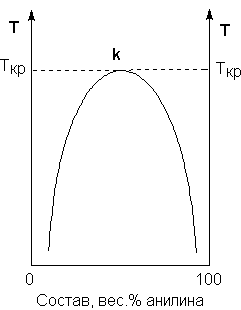
Рис. Диаграмма растворимости системы анилин – вода
Зависимость концентрации растворов от температуры принято изображать графически с помощью диаграммы взаимной растворимости. Эта диаграмма для системы анилин-вода приведена на рис. Область под кривой – это область расслаивания жидкостей. Повышение температуры приводит к увеличению концентрации каждого из растворов (увеличению взаимной растворимости), и при некоторой температуре, называемой критической температурой расслоения (Ткр на рис. 3.1) взаимная растворимость воды и анилина становится неограниченной. Система анилин – вода относится к т.н. системам с верхней критической температурой расслоения; существуют также и системы, для которых повышение температуры приводит к уменьшению взаимной растворимости компонентов.
Растворимость твердых веществ в жидкостях
Растворимость твердых веществ в жидкостях определяется природой веществ и, как правило, существенно зависит от температуры; сведения о растворимости твердых тел целиком основаны на опытных данных. Качественным обобщением экспериментальных данных по растворимости является принцип "подобное в подобном": полярные растворители хорошо растворяют полярные вещества и плохо – неполярные, и наоборот.
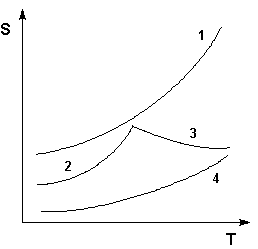
Рис. Кривые растворимости некоторых солей в воде.
1 – КNО3, 2 – Nа2SО4·10Н2О, 3 – Nа2SО4, 4 – Ва(NО3)2
Зависимость растворимости S от температуры обычно изображают графически в виде кривых растворимости (рис.). Поскольку теплота растворения твердых веществ в жидкостях может быть как положительной, так и отрицательной, растворимость при увеличении температуры может увеличиваться либо уменьшаться (согласно принципу Ле Шателье
Лекция 3 «Коллигативные свойства растворов».
Растворы – многокомпонентные равновесные системы, состоящие из растворенного вещества, растворителя и сольватов.
Растворы – термодинамически устойчивые гомогенные системы переменного состава, образованные из двух и более компонентов.
Растворителем называют вещество, содержащееся в растворе в наибольшем количестве. Остальные компоненты раствора называют растворенными веществами.
Существуют газообразные, жидкие и твердые растворы. Чаще встречаются жидкие растворы.
Коллигативными называются свойства растворов, которые не зависят от природы растворенного вещества, а только от его концентрации. Такие свойства проявляются в полной мере в идеальных растворах.
Идеальными называются растворы, при образовании которых не происходит изменения энтальпии и объема системы, не идут химические реакции между компонентами, а силы межмолекулярного взаимодействия между всеми компонентами одинакова. Наиболее близки к идеальным – разбавленные растворы неэлектролитов.
Для бесконечно разбавленных растворов, состояние которых близко к состоянию идеальных, такими свойствами являются:
– понижение давления насыщенного пара над раствором;
– повышение температуры кипения;
– понижение температуры замерзания раствора.
Изучение коллигативных свойств разбавленных растворов используется для определения молярной массы растворенного вещества, а также его степени диссоциации или показателя ассоциации.
Процесс самопроизвольного перехода (диффузии) растворителя через проницаемую перегородку из той части системы, где концентрация растворенного вещества ниже, в другую, где она выше, называется осмосом.
Количественно осмос характеризуется осмотическим давлением, т.е. давлением, которое нужно приложить к раствору, чтобы прекратить осмос. Осмотическое давление является мерой стремления растворенного вещества (вследствие теплового движения его молекул) перейти в процессе диффузии из раствора в чистый растворитель и равномерно распределиться по всему объему растворителя. Отрицательное изменение энергии Гиббса системы в процессе осмоса происходит главным образом за счет соответствующего изменения энтропийного фактора.
Осмотическое давление растет с увеличением концентрации раствора и температуры, т.е. следует примерно тому же закону, что и зависимость давления газа от тех же факторов. Вант-Гофф (1887) установил закон, согласно которому осмотическое давление раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора.
Это значит, что осмотическое давление идеального раствора можно вычислить по уравнению Менделеева – КлапейронарV= nRТ, где р == роем, V – объем, занимаемый раствором; n – число молей растворенного вещества.
Имея в виду, что n/V = с – молярная концентрация раствора, получаем уравнение, являющееся математическим выражением осмотического закона Вант-Гоффа:
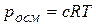
Растворы, имеющие одинаковое осмотическое давление, называют изотоническими. Если некоторый раствор А имеет большее осмотическое давление, чем раствор В, то в этом случае говорят, что А гипертоничен по отношению к раствору В или что раствор В гипотоничен по отношению к раствору. А.
Для растворов электролитов в уравнение для расчета осмотического давления необходимо ввести дополнительный поправочный коэффициент i, называемый изотоническим коэффициентом Вант-Гоффа, который равен отношению числа отдельных частиц (нормальных молекул, ионов или более простых дочерних молекул) N1 к общему числу молекул растворенного вещества N0) в объеме раствора:
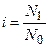
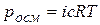
Если из общего числа молекул растворенного вещества a – часть их первоначального количества распалась на n дочерних частиц, а остальная часть молекул (1 – a) остается в неизменном виде, то изотонический коэффициент Вант-Гоффа будет равен
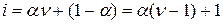
Для бинарного электролита, распадающегося на 2 иона (n = 2), например для NаС1, i == 1 + a; для тринарного электролита (n = 3), например для ВаСl2, i = 1 + 2a и т.д. Причем во всех случаях a – это степень диссоциации растворенного вещества, выраженная в долях единицы.
 2015-02-04
2015-02-04 849
849








