Взвешивают 5 г KNO3 и растворяют его в 75 мл воды. Записывают температуру раствора. Фиксируют изменение температуры только за счет проводимого процесса, поэтому опыт делят на три периода (для введения поправки на теплообмен):
а) начальный, продолжающийся не менее 5 мин;
б) главный – время протекания исследуемого процесса;
в) заключительный, сопровождающийся линейным изменением температуры.
Зафиксированную температуру записывают в тетрадь.
Таблица 1.
Зависимость изменения температуры раствора от времени
| Время от начала опыта, мин. | температура t, ˚С |
| 0,5 |
По экспериментальным данным строят зависимость изменения температуры во времени (рис. 2). Все построения выполняют на миллиметровой бумаге.
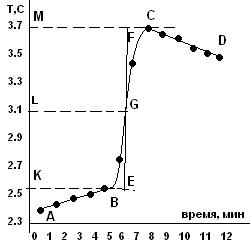
Рис. 2. Изменение температуры во времени.
Начальный период (участок АВ на рис. 2) служит для установления постоянной скорости теплообмена калориметра с окружающей средой в исходных условиях. Температура системы со временем может снижаться либо расти в зависимости от начальной разности температур воды в калориметрическом сосуде и окружающей среды. После установления равномерного изменения температуры следует провести, как минимум, десять измерений с интервалом 30 с.
После установления постоянной скорости теплообмена в калометрическом сосуде проводят химическую реакцию, в результате которой происходит выделение или поглощение тепла. Этот процесс – главный период (участок ВС на рис. 2 для экзотермической реакции). Продолжительность этого периода зависит от скорости процесса.
По окончании процесса происходит теплообмен калориметрической системы с окружающей средой, и время после установления постоянной скорости теплообмена называется конечным периодом (отрезок CD на рис. 2).
Истинное изменение температуры в ходе калориметрического опыта определяют графически. Для этого строят зависимость температуры от времени как на рис. 2. Точки С и В проектируются на ось ординат. Участок МК делится пополам и через точку L проводится прямая, параллельная оси абсцисс до пересечения с экспериментальной кривой в точке G, через которую проводится прямая, параллельная оси ординат. Отрезки АВ и CD, соответствующие начальному и конечному периодам, экстраполируют до пересечения с этой вертикальной прямой.
Отрезок EF показывает изменение температуры опыта с учетом поправки на теплообмен. Полученное с помощью графика изменение температуры ΔТ = EF соответствует изменению температуры при растворении соли или в ходе реакции, которое имело бы место, если бы удалось исключить теплообмен системы с окружающей средой во время процесса растворения или реакции.
Поскольку процесс в калориметре протекает при постоянном давлении, тепловой эффект изучаемого процесса равен изменению энтальпии системы:
Qр. = Ск·ΔТ =nΔΗ, где (1)
n – число молей реагирующего вещества.
Постоянную калориметра вычисляют по формуле:
Ск = 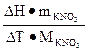 , (2)
, (2)
где ΔΗ – теплота растворения KNO3 в воде, значение которой есть в справочниках, mKNO3 – навеска KNO3, МKNO3 – молярная масса KNO3.
ΔΗ (KNO3)= - 35,65 кДж/моль (-8,52 Ккал/моль)
 2015-02-04
2015-02-04 5257
5257








