Задача 1. Рассчитать энтальпию образования метилового спирта из элементов
С(тв) + 2Н2(г) + ½О2(г) = СН3ОН(ж) + ∆НХ,
используя следующие данные:
∆НС(тв) = - 393,78 кДж/моль
∆НН2(г) = -286,03 кДж/моль
∆НСН3ОН(ж)= -627,59 кДж/моль
∆НО2(г) = 0.
Решение. Согласно следствию из закона Гесса тепловой эффект реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции:
∆Н = ∑ ∆Нсгор. исх. - ∑ ∆Нсгор. продуктов
С учетом стехиометрических коэффициентов находим энтальпию образования спирта:
∆НХ = -393,78 + 2·(-286,03)-(-627,59) = -338,25 кДж/моль
Ответ: -338,25 кДж/моль
Задача 2. Вычислите сколько литров азота (н.у.), участвовало в реакции с водородом при образовании аммиака, если оказалось, что при этом выделилось 18,45 кДж теплоты.
Решение:
N2 + 3Н2 → 2NН3
∆Н =∆Н0N2 + ∆Н0Н2 = - 46,19кДж/моль
½N2 + 1,5Н2 → NН3 - 18,45
VNН3= 0,5·22,4 = 11,2 л
 11,2 л NН3 — 46,19 кДж х =
11,2 л NН3 — 46,19 кДж х = 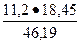 = 4,47 л
= 4,47 л
х л NН3 — 18,45 кДж
Ответ: 4,47 л
Задача 3. Вычислить изменение свободной энергии реакции (∆Gр) получения разбавленной уксусной кислоты из этанола на основании табличных данных стандартных свободных энергий образования веществ в водных растворах (∆Gобр) (см. приложение).
Решение. ∆Gр = ∑Gобраз.пр - ∑Gобраз.реаг
Реакция описывается суммарным уравнением:
С2Н5ОН(водн) + О2 → СН3СООН(водн) + Н2О(ж)
Применяя формулу для расчета свободной энергии реакции и данные условия, получим ∆Gр = -95,38 + (-56,69) – (-43,39) – 0 = -108,7 ккал/моль
Ответ: -108,7 ккал/моль
Задача 4. Образование сероводорода из простых веществ протекает по уравнению:
Н2(г)+S(р) → Н2S(г)
∆Н = -20,15 кДж. Вычислить ∆S0298 и ∆G0298. Возможно ли образование сероводорода из простых веществ при стандартных условиях.
Решение: ∆S0298(Н2) = 130,59 Дж/К·моль, ∆S0298(S) = 31,88 Дж/К·моль, ∆S0298(Н2S) = 205,64 Дж/К·моль
∆ S0298(Н2S) = ∑S прод. - ∑S исход.
∆S0298(Н2S) = 205,64 – 130,59 – 31,88 = 43,17 Дж/К·моль
∆G = ∆Н – Т∆S Т=298К
∆G0298 = -20,15·103 – 298·43,17= 33014,66 Дж
Ответ: 43,17 Дж/К·моль; 33014,66 Дж
Так как ∆G>0 образование сероводорода из простых веществ при стандартных условиях не возможно.
 2015-02-04
2015-02-04 8253
8253
