Раствор – термодинамическая система, состоящая не менее чем из двух компонентов, любая часть которой имеет одинаковый состав и химические свойства. Тот компонент, который присутствует в большем количестве, обычно называется растворителем, другие растворенными веществами. При растворении в жидкости газа или твердого вещества растворителем принято считать жидкость. Если раствор образован двумя компонентами, то он называется бинарным раствором.
Наиболее простым закономерностям подчиняются идеальные растворы, образуемые веществами, сходными по химическому составу и физическим свойствам. Отклонения от идеальности вызываются как химическими (ассоциация, химические взаимодействия и др.), так и физическими (различия молекулярных силовых полей) факторами.
Свойства идеального раствора (за некоторыми исключениями) не обладает ни один реальный раствор, однако, бесконечно разбавленные растворы, т.е. такие, для которых количеством растворенного вещества по сравнению с количеством растворителя можно пренебречь, практически ведут себя как идеальные смеси.
В растворах электролитов наблюдаются отклонения от свойств идеальных растворов вследствие электролитической диссоциации (суммарное число частиц в растворе электролитов выше, чем в растворе неэлектролита).
Для того, чтобы законы, выведенные для идеальных растворов, можно было использовать для растворов электролитов, вводится поправочный коэффициент – изотонический коэффициент Вант – Гоффа (i), показывающий во сколько раз изменяется фактическое число частиц в растворе вследствие диссоциации. Изотонический коэффициент определяется по уравнению:
i =1+α(n-1),
где α – степень диссоциации, n – фактическое число частиц, образующихся при диссоциации из одной молекулы электролита.
Для растворов электролитов i>1, для растворов неэлектролитов i=1, а для веществ, ассоциирующих в соответствующих растворителях i<1(например, бензойная кислота в бензоле).
Давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем, и зависит от концентрации раствора. Понижение давления пара над растворителем приводит к повышению температуры кипения и понижению температуры замерзания раствора по сравнению с чистым растворителем.
∆tз = tз растворителя – tз раствора;
∆tзам – понижение температуры замерзания раствора по сравнению с чистым растворителем.
Температурой кристаллизации раствора называется температура, при которой раствор данного состава находится в равновесии с чистым твердым растворителем.
Криоскопия - физико-химический метод изучения температур кристаллизации растворов. Криоскопический метод позволяет определить молярную массу растворенного вещества. В основе метода криоскопии лежит математическое выражение II закона Рауля: «Понижение температуры замерзания раствора по отношению к чистому растворителю прямопропорционально моляльной концентрации вещества», которое отражает следующая формула (для растворов неэлектролитов):
∆tзам = КСm, где:
К – коэффициент пропорциональности, называемый криоскопической константой.
Численно криоскопическая константа равна понижению температуры замерзания раствора с концентрацией 1 моль на 1000 г растворителя по сравнению с чистым растворителем. Криоскопическая константа воды равна 1,86°С/моль, для бензола 5,1°С/моль, для нафталина 7,1°С/моль, уксусной кислоты 3,9°С/моль. Криоскопическая константа не зависит от концентрации и природы растворенного вещества, а обусловлена лишь природой растворителя.
Сm – моляльная концентрация раствора, которая может быть рассчитана найдена по формуле:
Сm 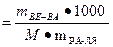 , где
, где
mве-ва – навеска растворенного вещества в граммах,
mра-ля – масса взятого растворителя,
М – молярная масса растворенного вещества.
Пользуясь основной формулой криоскопии, можно найти любую из входящих в нее величин, если измерены или известны остальные. При определении молярной массы эта формула принимает вид:
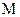
 2015-02-04
2015-02-04 705
705








