Зависимость электродных потенциалов от характера электродных процессов и активностей участвующих в них веществ позволяет использовать измерение ЭДС для нахождения коэффициентов активностей электролитов, стандартных электродных потенциалов, констант равновесия, произведений растворимости, рН растворов. Преимуществами потенциометрического метода – точность, объективность и быстрота определений.
Сущность метода. Известно, что рН = - lgан+. Потенциометрическое определение рН среды основано на применении индикаторных электродов, в электродной реакции которых участвуют ионы водорода, а потенциал зависит от рН. Измеряя ЭДС элемента, содержащего индикаторный электрод с исследуемым раствором, можно рассчитать рН этого раствора. В качестве второго электрода должен быть взят электрод с известным потенциалом.
Индикаторными (рабочими) называют электроды, потенциал которых однозначно меняется с изменением концентрации определяемых ионов.
Электродами сравнения называют такие электроды, потенциал которых точно известен, точно воспроизводим и не зависит от концентрации определяемых ионов, т.е. постоянен во время измерений.
По свойствам и по устройству обратимые электроды делят на следующие группы:
3. Электроды первого рода. 2. Электроды второго рода.
3. Окислительно-восстановительные электроды
4. Ионоселективные (мембранные) электроды.
Электроды первого рода. Электроды с активной твердой или газообразной фазой, обратимые либо только относительно катионов, либо только относительно анионов.
Сюда относят металлические электроды, обратимые относительно катионов, металлоидные электроды, обратимые относительно анионов, и газовые, обратимые или по отношению к катионам, или по отношению к анионам.
Металлические электроды, обратимые относительно катионов – это электроды, у которых металл опущен в раствор хорошо растворимой соли этого металла. Потенциалы электродов, обратимых относительно катиона, становятся более положительны с увеличением концентрации раствора.
Электроды второго рода – сложные многофазные электроды, формально обратимые как относительно катионов, так и относительно анионов. Они состоят из металла, труднорастворимой соли этого металла и второго соединения, хорошо растворимого и содержащего тот же анион, что и трудно растворимая соль.
Представители хлорсеребряный и каломельные электроды. Их широко используют в качестве электродов сравнения.
Хлорсеребряный представляет собой серебряную проволоку, покрытую слоем хлорида серебра, опущенную в насыщенный раствор хлорида калия, находящейся в сосуде с микрощелью для контакта с исследуемым раствором.
Ag׀AgCKC׀ll. Он обратим относительно хлорид ионов.
Каломельный электрод (Pt)Hg0│Hg2Cl2│KCl, состоящий из ртути, покрытой каломелью Hg2Cl2 и помещенной в раствор хлорида калия.
Окислительно-восстановительные электроды.
Все потенциалопределяющие электроды формируют потенциал на основе окислительно- восстановительных процессов, поэтому любой электрод может быть назван окислительно-восстановительным. Но условились окислительно-восстановительными называть такие электроды, металл которых не принимает участия в окислительно-восстановительной реакции, а является только переносчиком электронов, процесс же окисления-восстановления протекает между ионами, находящимися в растворе.
Такие электроды получают опусканием инертного металла в раствор смеси электролитов, содержащих ионы разной степени окисления.
Схема окислительно-восстановительного электрода:
(Pt)│Ох, Red;Ox + ze=Red
Примеры окислительно- восстановительных электродов: (Pt)│FeCl3;FeCl2 (Pt)│SnCl4;SnCl2.
Широко применяют хингидронный электрод: (Pt)│Х, Н2Х, Н+.
Он состоит из платиновой пластинки опущенной в раствор хингидрона. Это комплексное соединение из хинона и его восстановленной формы гидрохинона. На электроде протекает реакция:
С6Н4О2 + 2Н +2е = С6Н4(ОН)2
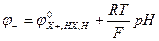
Его нельзя использовать при анализе щелочных сред, т.к. гидрохинон реагирует с ионами гидроксила. Достоинство низкая погрешность результатов.
Ионообменные (ионоселективные) электроды. Электроды, состоящие из ионита и раствора, потенциал на границе раздела фаз которых возникает за счет избирательного ионообменного процесса между фазами.
Стеклянный электрод Ag│AgCl│HCl. Это тонкостенный шарик из специального токопроводящего стекла (мембраны), наполненной раствором соляной кислоты 0,1 моль/л. В раствор HCl погружен вспомогательный хлоридсеребрянный электрод.
Принцип действия основан на том, что в структуре стекла катионы калия, натрия и лития могут обмениваться с катионами раствора (Н+). Обмен катионами между стеклом и раствором происходит в соответствии с законом распределения третьего компонента между двумя фазами. Из-за различия активностей катионов в растворе и в мембране на обеих сторонах мембраны возникают граничные потенциалы φ1 и φ2. Чувствительностью к ионам водорода обладает только хорошо вымоченная мембрана. Поэтому перед использованием стеклянные электроды готовят. Вначале гидратируют стекло. Выдерживают несколько часов в воде, а затем в 0,1 М растворе HCl.
Стеклянный электрод имеет высокое сопротивление, ограничение диапазона измерения рН (-1-12). Его потенциал изменяется во времени, поэтому его градуируют по стандартным буферным растворам. Достоинство – индифферентность к окислителям и восстановителям. Изменяя состав стекла, можно получить мембраны, обладающие пониженной селективностью к ионам водорода и высокой к ионам металла (натрия, калия).
Гальванические цепи. В зависимости от характера электродов, применяемых при составлении цепи при потенциометрическом определении рН, обычно применяют такие гальванические цепи:
Рt / Н2/ [Н+]С1 // КС1 // [Н+] С2 Рt /Н2 - концентрационная водородная цепь (С1[Н+] ≠ С2 [Н+])
Нg /Нg2С12 / КС1 // КС1 // [Н+]х Рt / Н2 - каломельно-водородная цепь
Рt /Н2 / [Н+]х + хингидрон //КС1 // КС1, Нg2С12 / Нg - хингидронно-каломельная цепь.
Рt / Н2/ [Н+]х +хингидрон //КС1 // [Н+] С2 + хингидрон Рt / Н2 - двойная хингидронная цепь.
Измерение ЭДС. Для измерения ЭДС гальванической цепи применяется компенсационный метод. При этом методе измеряемой ЭДС противопоставляется таковая, которая равна ей по величине, но противоположная по направлению.
Определяемая ЭДС (Ех) вычисляется по формуле:
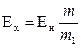
где Ен – ЭДС нормального электрода.
Выражение рН через ЭДС. рН среды связан простым численным соотношением с ЭДС, гальванической цепи. Например, для водородной цепи применяем формулу для концентрационной цепи:
1. Е1 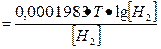
при 25°С Е = 0,0001983• Т = 0,059
при 18°С Е = 0,0001983•Т = 0,058
2. Е18°с =0,058 рН2 – 0,058 рН1
3. рН1= 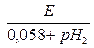
Если электродом сравнения является нормальный водородный электрод, то рН1 = 0 и последняя формула приобретает вид:
рН2 = 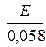
Формула рНх = 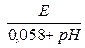 может быть применена и для двойной хингидронной цепи. Хингидронный электрод сравнения в этом случае обычно содержит буферную смесь из раствора соляной кислоты и раствора хлорида калия с величиной рН1= 2,04. Предыдущая формула принимает при этом следующий вид:
может быть применена и для двойной хингидронной цепи. Хингидронный электрод сравнения в этом случае обычно содержит буферную смесь из раствора соляной кислоты и раствора хлорида калия с величиной рН1= 2,04. Предыдущая формула принимает при этом следующий вид:
рНх (18оС) = 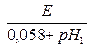
Как видно из этой формулы, для определения рН исследуемого раствора необходимо составить двойную хингидронную цепь, измерить ее ЭДС и подсчитать значение рН по этой формуле с точностью до сотых долей единицы.
C помощью водородного показателя принято характеризовать:
1) реакцию почвенной среды водной вытяжки;
2) реакцию солевой (1,0 н. раствором КС1) вытяжки из почв;
3) обменную кислотность: по количеству щелочи, затрачиваемой на титрование солевой (1,0 н. KС1) вытяжки;
4) гидролитическую кислотность по количеству щелочи, затраченной на титрование водной вытяжки.
Активная реакция водной вытяжки зависит от присутствия в почве легко растворимых кислот, солей и углекислого газа. Активную кислотность определяют для всех типов почв.
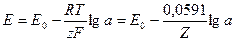
 2015-02-04
2015-02-04 4874
4874
