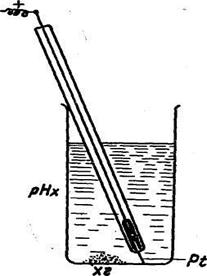
Хиндгидронный электрод состоит из платиновой проволоки, опущенной в раствор, содержащий ионы водорода и хингидрон: Рt/хингидрон, Н+.
Хингидронный электрод относится к окислительно-восстановительным, т. е. таким, у которых металл не принимает участия в электродной реакции, а является проводником электронов.
 Хингидрон представляет собой двойное соединение хинона гидрохинона
Хингидрон представляет собой двойное соединение хинона гидрохинона 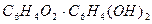 , малорастворимое в воде. Растворяясь в воде, хингидрон распадается по следующим уравнениям:
, малорастворимое в воде. Растворяясь в воде, хингидрон распадается по следующим уравнениям:
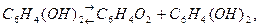
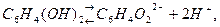

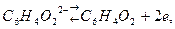
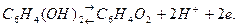
Величина его окислительно-восстановительного потенциала выражается уравнением Нернста:
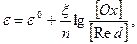
где
[Ох] — концентрация окисленной формы;
[Red] — концентрация восстановленной формы. Для хингидронного электрода
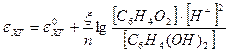 ,
,
так как в насыщенном водном растворе Рис.6. Хингидронный электрод
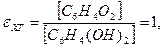
то 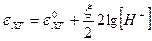 ,
,
или 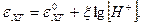
Стандартный (нормальный) потенциал хингидронного электрода при 18°С 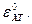 = 0,7044 в.
= 0,7044 в.
Гальванические цепи. В зависимости от характера электродов, применяемых при составлении цепи при потенциометрическом определении рН, обычно применяют такие гальванические цепи:
Рt / Н2/ [Н+]С1 // КС1 // [Н+] С2 Рt /Н2 - концентрационная водородная цепь (С1[Н+] ≠ С2 [Н+])
Нg /Нg2С12 / КС1 // КС1 // [Н+]х Рt / Н2 - каломельно-водородная цепь
Рt /Н2 / [Н+]х + хингидрон //КС1 // КС1, Нg2С12 / Нg - хингидронно-каломельная цепь.
Рt / Н2/ [Н+]х +хингидрон //КС1 // [Н+] С2 + хингидрон Рt / Н2 - двойная хингидронная цепь.
Измерение ЭДС. Для измерения ЭДС гальванической цепи применяется компенсационный метод. При этом методе измеряемой ЭДС противопоставляется таковая, которая равна ей по величине, но противоположная по направлению.
Определяемая ЭДС (Ех) вычисляется по формуле:
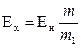
где Ен – ЭДС нормального электрода.
Выражение рН через ЭДС. рН среды связан простым численным соотношением с ЭДС, гальванической цепи. Например, для водородной цепи применяем формулу для концентрационной цепи:
1. Е1 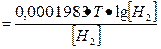
при 25°С Е = 0,0001983• Т = 0,059
при 18°С Е = 0,0001983•Т = 0,058
2. Е18°с =0,058 рН2 – 0,058 рН1
3. рН1= 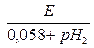
Если электродом сравнения является нормальный водородный электрод, то рН1 = 0 и последняя формула приобретает вид:
рН2 = 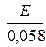
Формула рНх = 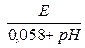 может быть применена и для двойной хингидронной цепи. Хингидронный электрод сравнения в этом случае обычно содержит буферную смесь из раствора соляной кислоты и раствора хлорида калия с величиной рН1= 2,04. Предыдущая формула принимает при этом следующий вид:
может быть применена и для двойной хингидронной цепи. Хингидронный электрод сравнения в этом случае обычно содержит буферную смесь из раствора соляной кислоты и раствора хлорида калия с величиной рН1= 2,04. Предыдущая формула принимает при этом следующий вид:
рНх (18оС) = 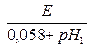
Как видно из этой формулы, для определения рН исследуемого раствора необходимо составить двойную хингидронную цепь, измерить ее ЭДС и подсчитать значение рН по этой формуле с точностью до сотых долей единицы.
C помощью водородного показателя принято характеризовать:
5) реакцию почвенной среды водной вытяжки;
6) реакцию солевой (1,0 н. раствором КС1) вытяжки из почв;
7) обменную кислотность: по количеству щелочи, затрачиваемой на титрование солевой (1,0 н. KС1) вытяжки;
8) гидролитическую кислотность по количеству щелочи, затраченной на титрование водной вытяжки.
Активная реакция водной вытяжки зависит от присутствия в почве легко растворимых кислот, солей и углекислого газа. Активную кислотность определяют для всех типов почв.
Вопросы для подготовки и контроля знаний
12. Характеристика электрохимических процессов.
13. Чем объясняется возникновение скачка потенциала на границе металл – раствор. Строение двойного электрического слоя.
14. Формула Нернста для вычисления электродного потенциала.
15. Гальванический элемент. Типы гальванических элементов.
16. Дайте характеристику: химические и концентрационные цепи. Приведите пример расчета Э.Д.С.
17. Классификация электродов.
18. Концентрационный гальванический элемент.
19. Электроды сравнения.
20. Почему водородный электрод не относят к индикаторным? Где используют? Недостатки водородного электрода.
21. Потенциометрическое титрование.
22. Химические источники тока.
 2015-02-04
2015-02-04 11771
11771







