1. В лабораторных условиях растворитель можно отделить от растворенного вещества:
1) декантацией 3) перегонкой
2) фильтрованием отстаиванием 4) распределения
2 На растворимость углекислого газа в воде не влияет:
1) давление 3) химическое взаимодействие газа с водой
2) скорость пропускания газа 4) температура
3 Гетерогенная система, где дисперсной средой является газ, а дисперсной фазой - жидкость, называется…
1) эмульсия 3) суспензия
2) аэрозоль 4) пена
4 В коллоидном растворе, полученном при взаимодействии растворов силиката калия и серной кислоты (избыток), потенциалоопределяющим ионом является…
1) ион водорода 2) силикат-ион
2) ион калия 3) сульфат-ион
5 Для золя сульфата бария, полученного по реакции:
BaCl2(изб)+K2SO4, наименьшим порогом коагуляции обладает…
1) AlCl3 3) K3PO4
2) K2SO4 4) KCl
6 Для золя сульфата бария. полученного по реакции:
BaCl2(изб)+K2SO4, наиболее сильным коагулирующим действием обладает ион…
1) K+ 3) PO43-
2) Al3+ 4) Cl-
7 К неорганическим полимерам относятся …
1) эбонит 3) плексиглас
2) фторопласт 4) асбест
8. В лаборатории в химическом стакане на пламени газовой горелки нагревается вода. Температура кипения жидкости повысится, если:
1) накрыть стакан с водой крышкой 3) добавить в воду поваренной соли
2) увеличить пламя газовой горелки 4) уменьшить пламя газовой горелки
9. Туман - это распределение частиц…
1) твердого вещества в газе 3) газа в газе
2) жидкости в газе 4) жидкости в жидкости
10. Золь образуется в результате процесса:
1) адсорбции 3) электрофореза
2) диссоциации электролитической 4) осмоса
11. Суспензиями называются дисперсные системы, в которых…
1) газообразные частицы распределены в жидкости;
2) газообразные частицы распределены в газе;
3) капли жидкости распределены в другой жидкости;
4) твёрдые частицы распределены в жидкости.
12. Эмульсиями называются дисперсные системы, в которых…
1) газ распределён в жидкости;
2) газ распределён в газе;
3) капли одной жидкости распределены в другой;
4) твёрдые частицы распределены в газе.
13. В истинных растворах размер раздробленных частиц колеблется в пределах (см)…
1) 10-1- 10-2 3) 10-5-10-7
2) 10-2-10-5 4) 10-7-10-8
14. Коллоидными называются дисперсные системы, в которых размер раздробленных частиц колеблется в пределах (см)…
1)1-10-2 3) 10-5-10-7
2) 10-2-10-2 4) 10-7-10-8
15. Непрерывное хаотическое движение частиц, возникающее за счёт воздействия молекул дисперсионной среды, называется…
1) броуновским; 3) безинерционным;
2) поступательным; 4) молекулярным
16. Разрушение электролитами сольватной (гидратной) оболочки макромолекул, в результате чего они выпадают в осадок, называется…
1) разложением; 3) высаливанием;
2) осаждением; 4) пептизацией.
17. Структурированные дисперсные системы с жидкой дисперсной средой, состоящие из заполненного жидкостью каркаса, называются…
1) золями; 3) эмульсиями;
2) гелями; 4) пенопластом.
18. Слой, образующийся на границе раздела твёрдое тело-жидкость и состоящий из потенциалообразующего слоя на твёрдой поверхности одного знака и противоионов в жидкой фазе, называется…
1) заряженным слоем; 3) двойным электрическим слоем;
2) адсорбционным слоем; 4) слоем ионов.
19. Потенциал диффузной части двойного электрического слоя по границе скольжения, определяющий возможность перемещения дисперсной фазы относительно дисперсной среды, называется…
1) ионизационным потенциалом; 3) электрическим потенциалом;
2) дзета-потенциалом; 4) редоксопотенциалом;
20. Методом очистки коллоидных систем является…
1) диализ; 3) пептизация;
2) осаждение твёрдой фазы; 4) электрофорез;
21 Седиментационно-устойчивые высокодисперсные системы с твёрдой дисперсной фазой и жидкой дисперсной средой называются…
1) студни; 2) золи; 3) гели; 4) ксерогели;
22 Состояние двойного электрического слоя коллоидной частицы, при котором дзета-потенциал равен нулю, называется…
1) состоянием равновесия; 3) изоэлектрической точкой;
2) переходным состоянием; 4) нулевым состоянием;
23 Слипание частиц твёрдой дисперсной фазы называется…
1) когезией 3) коагуляцией;
2) адсорбцией; 4) образованием осадка;
24 Слияние капель внутри подвижной дисперсионной среды (жидкости или газа) и образование частиц большего размера по сравнению с исходным называется…
1) адсорбцией; 3) пептизацией;
2) коалесценцией; 4) седиментацией;
25 Оседание коллоидных частиц под действием силы тяжести называется…
1) электрофорезом; 3) седиментацией;
2) электроосмосом; 4) коацервацией;
26 Коллоидные системы, характеризующиеся слабым взаимодействием (отсутствием взаимодействия) между дисперсной фазой и дисперсионной средой, термодинамически неустойчивые и не способные к самопроизвольному диспергированию называются…
1) раздробленные; 3) лиофобные;
2) неустойчивые; 4) закрытые;
27 Коллоидные системы, характеризующиеся интенсивным взаимодействием дисперсной фазы и дисперсионной среды, термодинамически устойчивые и способные образовываться самопроизвольно путём диспергирования, называются…
1) устойчивыми; 3) лиофильными;
2) лиофобными; 4) открытыми;
28 Увеличение массы и объёма геля в результате поглощения низкомолекулярной жидкости или её пара называется…
1) набуханием; 3) гидратацией;
2) растворением; 4) седиментацией;
29 Метод определения размеров и концентрации коллоидных частиц, основанный на способности дисперсных систем рассеивать свет, называется…
1) нефелометрия; 3) спектроскопия;
2) криоскопия; 4) эбулиоскопия;
30 Способность гелей восстанавливаться после разрушения называется…
1) устойчивостью; 3) пептизацией;
2) тиксотропией; 4) сублимацией;
31 Самопроизвольное выделение жидкой фазы из студней и гелей, сопровождающееся уменьшением их объёма, называется…
1) тиксотропией; 3) смачиванием;
2) синерезисом; 4) солюбилизацией;
32 Движение гранул коллоидных частиц в электрическом поле называется…
1) электрофорезом; 3) тиксотропией;
2) электроосмосом; 4) электролизом;
33 Переход осадка во взвешенное состояние под действием других веществ называется…
1) пептизацией; 3) тиксотропией;
2) седиментацией; 4) опалесценцией;
34 Опалесценция – это явление рассеивания света…
1) истинными растворами; 3) коллоидными системами;
2) стеклянной пластиной; 4) ионселективным электродом;
35 Правило определяющее особенность коагуляции коллоидных систем электролитами - …
1) правило Траубе – Дюкло; 3) правило Шульца – Гарди;
2) правило Фаянса – Панета; 4) правило Эйнштейна – Смолуховского;
36. Электрическая проводимость проводников I рода обусловлена подвижностью:
1) электронов, 3) ионов,
2) атомов, 4) молекул.
37. Электрическая проводимость проводников II рода обусловлена подвижностью:
1) электронов, 3) ионов,
2) атомов, 4) молекул.
38. Зимой во время гололеда обледеневшую дорогу посыпают хлоридом натрия и кальция, в результате чего лед тает. Это объясняется:
1) образуется раствор, температура замерзания которого выше, чем у растворителя;
2) образуется раствор, температура замерзания которого ниже, чем у растворителя;
3) происходит выделение теплоты;
4) происходит поглощение теплоты.
39. Укажите неверное утверждение:
1) кипит при более высокой температуре, чем чистая вода;
2) замерзшая морская вода плавится при более низкой температуре, чем лед;
3) температура кипения морской воды повышается по мере ее испарения;
4) плотность морской воды равна плотности чистой воды..
40. При растворении 1 моль безводной соды выделяется 25 кДж теплоты, а при растворении 1 моль кристаллогидрата поглощается 67 кДж теплоты. Укажите тепловой эффект реакции гидратации безводной соды:
1) +92, 2) -42, 3) +42, 4) -92.
41. Г. Гесс в 1840 г сформулировал основной закон термохимии: тепловой эффект процесса зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути перехода. Какое из утверждений является важным следствием из закона:
1) тепловой эффект реакции равен теплотам образования исходных веществ,
2) тепловой эффект реакции равен теплотам образования продуктов реакции,
3) тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ,
4) тепловой эффект реакции равен сумме теплот образования продуктов реакции и теплот образования исходных веществ.
42. Электрическая проводимость объема раствора, содержащего 1 к моль растворенного вещества между электронами, находящимися на расстоянии 1 м друг от друга называется:
1) молярной электрической проводимостью,
2) удельной электрической проводимостью,
3) молярным электрическим сопротивлением,
4) электролитической подвижностью.
43. Молярная электропроводимость растворов электролитов при разбавлении:
1) увеличивается,
2) уменьшается,
3) не меняется,
4) возрастает до максимума, а затем уменьшается.
44. Электролитическая подвижность ионов выражается уравнениями:
1) 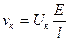
 ,
, 

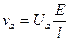 ;
;
2) λv = αF (Uk + Ua), λ∞ = F (Uk + Ua);
3) λк = UкF, λa = UaF;
4) λ∞ = λк + λa, λк= λ∞- λa.
45. По закону Ф. Кольрауша молярная электрическая проводимость при бесконечном разбавлении λ∞ для данного электролита равна:
1) разности электролитических подвижностей катиона и аниона, 

2) сумме электролитических подвижностей катиона и аниона,
в) произведению электролитических подвижностей катиона и аниона,
4) сумме абсолютных скоростей движения катиона и аниона.
46. Скорость реакции 2А + Б = В + Г можно записать выражением, если считать, что реакции идет в одну стадию:
1) v=k[Б],  3) v=k[А][Б],
3) v=k[А][Б],
2) v=k[А]2[Б], 4) v=k[А]2.
47. Определение влажности сыпучих (зерна) и сплошных (текстиль) объектов кондуктометрией основано на зависимости: чем меньше влажность материалов тем:
1) меньше их электрическая проводимость, 

2) больше их электрическая проводимость,
3) больше их электрическое сопротивление,
4)больше скорость движения катионов и анионов.
48. Катализатор ускоряет химическую реакцию по причине:
1) снижения энергии активации,  3) возрастания теплоты реакции,
3) возрастания теплоты реакции,
2) повышения энергии активации, 4)уменьшения теплоты реакции..
49. Гальваническим элементом называется устройство, в котором энергия химической реакции непосредственно превращается в электрическую. Он состоит из:
1) пластин разноименных металлов соединенных между собой проводником и погруженных в соприкасающиеся между собой разные растворы электролитов,
2) одинаковых металлических пластин, соединенных проводником и погруженных в растворе электролитов,
3) соединенных между собой пластин металлов, погруженных в растворы,
4) пластин металлов, погруженных в растворы их солей.
50. Электродным потенциалом называется:
1) разность потенциалов между поверхностью металлической пластины погруженной в раствор и раствором,
2) разность потенциалов между пластинками погруженными в разные растворы,
3) разность потенциалов между пластинами опущенными в один и тот же раствор.
4) потенциал возникающий на пластине при погружении в раствор.
51. ЭДС гальванического элемента равна:
1) сумме электродных потенциалов, составляющих его химических электродов,
2) разности электродных потенциалов, составляющих его химических электродов,
3) разности электродных потенциалов электродов, находящихся в различных электролитах,
4) разности стандартных потенциалов, составляющих его химических электродов.
52. Стандартным нормальным электродным потенциалом называется:
1) величина потенциала, возникающая на металлической пластине, погруженного в раствор одноименного пластине иона с концентрацией равной 1 моль экв/л,
2) величина потенциала, возникающая на металлической пластине, погруженного в раствор соли с концентрацией равной 1 моль/л,
3) величина потенциала, возникающая на металлической пластине, погруженного в однонормальный раствор кислоты,
4) величина потенциала, возникающая на металлической пластине, погруженного в однонормальный раствор щелочи.
53. Уравнение Нернста показывает как зависит величина электродного потенциала от:
1) температуры,
2) величины стандартного потенциала, температуры, заряда иона и концентраций электролита,
3) природы электролита,
4) природы металла.
54. Потенциал стандартного водородного электрода принято считать равным:
1) 1 вольту, 3) -1 вольту,
2) нулю, 4) 0,1 вольта.
55. Химические электроды I рода:
1) пластины металлов, погруженные в раствор катионов того же металла,
2) пластинки (проволока) металлов, покрытые слоем трудно растворимой соли и погруженные в раствор аниона, входящие в состав этой соли,
3) пластинки металлов погруженные в воду,
56. Химические электроды II рода:
1) пластины металлов, погруженные в раствор катионов того же металла,
2) пластинки (проволока) металлов, покрытые слоем трудно растворимой соли и погруженные в раствор аниона, входящие в состав этой соли,
3) пластинки металлов погруженные в воду,
57. Электроды I и II рода:
1) цинковый, медный,
2) хлорсеребряный, каломельный,
3) цинковый, хлорсеребряный,
4) водородный, медный.
58. Электроды измерительный и сравнения:
1) цинковый, медный, 3) хингидронный, стеклянный,
2) хлорсеребряный, каломельный, 4) стеклянный, хлорсеребряный.
59. Измерение ЭДС гальванического элемента обычно проводят:
1) вольтметром, 3) аккумулятором,
2) амперметром, 4) трансформатором.
60. В концентрационных гальванических элементах электрическая энергия образуется за счет:
1) разницы концентраций растворов, при одинаковой химической природе составляющих цепь электродов,
2) одинаковости концентраций растворов при одинаковых электродах,
3) равности концентраций растворов при электродах разной химической природы,
4) выравнивания концентраций растворов в процессе работы гальванического элемента.
61. Диффузионным потенциалом называют скачок потенциала на границе раздела:
1) разных фаз,
2) разных по составу растворов,
3) неодинаковых по составу, подвижности ионов и по концентрации растворов,
4) растворов с различной температурой.
62. Окислительно-восстановительный электрод это система, состоящая из:
1) инертного металла, погруженного в растворы солей с катионами или анионами переменной степени окисления,
2) металлических пластин погруженных в растворы солей с катионами переменной степени окисления,
3) металлических пластин с двойным электрическим слоем из анионов переменной степени окисления,
4) пластин инертного металла с двойным электрическим слоем из катионов переменной степени окисления.
63. Потенциал, возникающий на границе соприкосновения пластинки из инертного металла с раствором, содержащим ионы различной степени окисления называют:
1) электродным, 3) концентрационным,
2) диффузионным, 4) окислительно-восстановительным.
64. Как сказывается увеличение окислительно-восстановительных потенциалов почв на процессы фиксации атмосферного азота микроорганизмов:
1) положительно, 3) не существенно,
2) отрицательно, 4) значительно при ухудшении аэрации почв.
65. Равновесие реакции Fe3O4+4CO = 3Fe + 4СО2 – 43,7 кДж смещается влево при:
1) понижении температуры, 3) уменьшении давления,
2) повышении температуры, 4) увеличении давления.
66. Химическая термодинамика изучает:
1) скорость химической реакции;
2) процессы образования растворов;
3) зависимость свойств веществ от их строения;
4) взаимопревращения различных форм энергии и законы этих превращений.
67. Система, внутри которой нет поверхностей, разделяющих отличающиеся по свойствам части системы (фазы) называется:
1) изолированной; 3) гомогенной;
2) однофазной; 4) гетерогенной.
68. Совокупность гомогенных частей гетерогенной системы одинаковых по физическим и химическим свойствам, отделенная от других частей системы видимыми поверхностями раздела называется:
1) фаза; 3) среда;
2) окружающая среда; 4) частица.
69. Чему равен рН 0,01 М раствора гидроксида калия:
1) 0,01; 2) 2; 3) 10; 4) 12.
70. Раствор, значение рН которого практически не изменяется при добавлении к нему некоторых количеств кислоты или основания, называется:
1) нейтральным; 3) буферным;
2) кислым; 4) щелочным.
71. В гальваническом элементе, состоящем из железной пластины, погруженной в раствор сульфата железа(II) и медной пластины, погруженной в раствор сульфата меди, соединенных электролитическим мостиком из насыщенного раствора хлорида калия, протекает следующая окислительно-восстановительная реакция:
1) Fe0 + Cu2+= Fe2+ + Cu0; 3) Fe2+ + 2Cl-= Fe0 + Cl2;
2) Cu0 +Fe2+ = Cu2+ +Fe0; 4) Cu2++ 2Cl-= Cu0 +Cl2
72. Согласно первому закону термодинамики
1) полная энергия изолированной системы постоянна;
2) полная энергия изолированной системы непостоянна;
3) полная энергия неизолированной системы непостоянна;
4) полная энергия неизолированной системы постоянна.
73. Математическая запись 1го начала термодинамики:
1) Q = ∆U – A; 3) Q = ∆U + A;
2) Q = A - ∆U; 4) ∆ U = ∆Q + ∆ A.
74. Два инертных электрода (платиновых или угольных) опущены в стакан, содержащий 0,1 М водные растворы нитрата серебра, нитрата меди и нитрата свинца. При пропускании постоянного электрического тока первым на катоде будет восстанавливаться:
1) серебро; 2) медь; 3) цинк; 4) все три металла одновременно.
75. Во время электролиза водного раствора хлорида натрия среда у катода становится:
1) щелочная; 2) слабокислая; 3) сильнокислая; 4) нейтральная.
76. Чтобы рН раствора уменьшить на 1, концентрацию ионов водорода надо увеличить в:
1) 0,1 раза; 2) 10 раз; 3) 2,3 раза; 4) 100 раз.
77. Тепловой эффект изобарного процесса равен:
1) сумме энтальпий исходных веществ и энтальпий продуктов реакции;
2) изменению энтальпии системы;
3) внутренней энергии системы;
4) сумме энтальпий продуктов реакции;
78. Первое начало термодинамики позволяет:
1) судить о самопроизвольном протекании процесса;
2) о направлении протекания процесса;
3) о глубине протекания процесса;
4) рассчитать энергетический эффект процесса.
79. Термохимическое уравнение C6H12O6 + 6H2O = 6CO2 + 6H2O, ∆ H = -2800 кДж соответствует процессу
1) эндотермическому; 3) политермическому;
2) экзотермическому; 4) экстенсивному.
80. Согласно закону Гесса теплота химической реакции не зависит от путей перехода, а зависит только от:
1) начального и конечного состояния веществ;
2) агрегатного состояния веществ;
3) условий протекания реакции;
4) изменения внутренней энергии.
81. Второе начало термодинамики позволяет:
1) рассчитать энергетический эффект процесса;
2) определить направление превращения энергии;
3) рассчитать температуру процесса;
4) определить теплоты образования простых веществ.
82. Укажите все формулировки, подтверждающие второе начало термодинамики:
а) теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому;
б) теплота может самопроизвольно переходить от менее нагретого тела к более нагретому;
в) невозможен процесс, единственным результатом которого является превращение теплоты в работу;
г) возможен процесс, единственным результатом которого является превращение теплоты в работу;
д) невозможно построить машину, все действия которой сводились бы к производству работы за счет охлаждения теплового источника (вечный двигатель второго рода)
1) а; в; д;
2) б; г; д;
3) а; г;
4) д.
83. Термодинамическая функция, которая дает возможность определить степень обратимости различных процессов в изолированных системах:
1) энтальпия; 2) энтропия; 3) энергия Гиббса; 4) константа равновесия.
84. Термодинамическая функция, которая дает возможность определить степень обратимости различных процессов в неизолированных системах:
1) энтальпия; 2) энтропия; 3) энергия Гиббса; 4) константа равновесия.
85. В изолированных системах самопроизвольно могут протекать только процессы, сопровождающиеся
1) уменьшением энтропии; 3) увеличением энтропии;
2) увеличением энтальпии;4) уменьшением энтальпии.
86. В обратимых изотермических процессах изменение энтропии равно:
1) ∆ S= 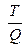 ; 2) ∆ S= Q; 3) ∆ S=
; 2) ∆ S= Q; 3) ∆ S= 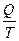 ; 4) ∆ S= Т.
; 4) ∆ S= Т.
87. Согласно тепловой энергии Нернста при абсолютном нуле энтропия любого однородного тела
1) не равна нулю; 3) меньше нуля;
2) больше нуля; 4) равна нулю.
88. С увеличением константы равновесия химической реакции свободная энергия
1) увеличивается; 2) уменьшается; 3) не изменяется; 4) нет ответа.
89. Как изменится энтропия в следующих процессах (последовательно): плавление льда, получение аммиака (N2 + 3H2 = 2NH3), растворение поваренной соли в воде.
1) уменьшится, увеличится, увеличится:
2) увеличится, уменьшится, увеличится;
3) увеличится, увеличится, уменьшится;
4) уменьшится, увеличится, уменьшится.
90. Растворимость газов в растворах солей
1) больше, чем в чистой воде; 3) такая же, как и в чистой воде;
2) меньше, чем в чистой воде; 4) не растворяются.
91. С увеличением концентрации электролита растворимость газов в растворах электролитов
1) увеличивается; 3) не изменяется;
2) уменьшается; 4) нет правильного ответа.
92. С повышением температуры растворимость газов в жидкостях как правило
1) увеличивается; 3) не изменяется;
2) уменьшается; 4) не растворяются.
93. С увеличением давления при постоянной температуре растворимость газа в жидкости:
1) увеличивается; 3) не изменяется;
2) уменьшается;4) нет правильного ответа.
94. На растворимость твердых веществ в жидкостях влияют:
а) природа растворяемого вещества; б) природа растворителя; в) температура; г)давление
1) а; б; в;2) а; б; в; г; 3) в; г; 4) а; б.
95. Растворы, имеющие одинаковое осмотическое давление называются:
1) изохороческими; 3) гипотоническими;
2) гипертоническими; 4) изотоническими.
96. Согласно первому закону Рауля:
1) давление пара раствора, содержащего нелетучее растворенное вещество обратно пропорционально молярной доле растворителя;
2) давление пара раствора, содержащего нелетучее растворенное вещество обратно пропорционально молярной доле растворенного вещества;
3) давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально молярной доле растворителя;
4) давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально молярной доле растворенного вещества.
97. Относительное понижение давления пара для данного раствора зависит от
1) природы растворенного вещества; 3) температуры;
2) природы растворителя; 4) концентрации раствора.
98. Эбулиоскопическая константа зависит только от
1) природы растворенного вещества; 3) природы растворителя;
2) концентрации раствора; 4) давления.
99. Криоскопическая константа зависит только от
1) природы растворенного вещества; 3) природы растворителя;
2) концентрации раствора; 4) давления.
100. рН раствора с рОН = 7,5 равна
1) 6,5; 2) 2,5; 3) 14,5; 4) – 0,5.
 2015-02-04
2015-02-04 1730
1730







