В регуляции обмена веществ и энергии выделяют регуляцию обмена организма веществами и энергией с окружающей средой и регуляцию метаболизма в самом организме.
Регуляция обмена организма с окружающей средой питательными веществами рассматривается в главе 9.
Вопросы регуляции водно-солевого обмена описаны в главе 12. Регуляция обмена организма с окружающей средой теплом, как конечной формой превращения всех видов энергии, обсуждается в главе 11.
Поэтому здесь представлены общие вопросы нейрогуморальной регуляции обмена веществ и энергии в организме и, главным образом, регуляция метаболизма целостного организма.
Конечной целью регуляции обмена веществ и энергии является удовлетворение в соответствии с уровнем функциональной активности потребностей целостного организма, его органов, тканей и отдельных клеток в энергии и разнообразных пластических веществах. В целостном организме постоянно существует необходимость согласования общих метаболических потребностей организма с потребностями клетки органа, ткани. Такое согласование достигается посредством распределения между органами и тканями веществ, поступающих из окружающей среды, и перераспределения между ними веществ, синтезирующихся внутри организма.
Обмен веществ, протекающий внутри организма, не связан прямыми способами с окружающей средой. Питательные вещества,
467






 прежде чем они смогут вступить в обменные процессы, должны быть получены из пищи в желудочно-кишечном тракте в молекулярной форме. Кислород, необходимый для биологического окисления, должен быть выделен в легких из воздуха, доставлен в кровь, связан с гемоглобином и перенесен кровью к тканям. Скелетные мышцы, являясь в организме одним из мощных потребителей энергии, также обслуживают обмен веществ и энергии, обеспечивая поиск, прием и обработку пищи. Непосредственное отношение к обмену веществ и энергии имеет выделительная система. Таким образом, регуляция обмена веществ и энергии — это мультипарамет-рическая регуляция, включающая в себя регулирующие системы множества функций организма (например, дыхания, кровообращения, выделения, теплообмена и др.).
прежде чем они смогут вступить в обменные процессы, должны быть получены из пищи в желудочно-кишечном тракте в молекулярной форме. Кислород, необходимый для биологического окисления, должен быть выделен в легких из воздуха, доставлен в кровь, связан с гемоглобином и перенесен кровью к тканям. Скелетные мышцы, являясь в организме одним из мощных потребителей энергии, также обслуживают обмен веществ и энергии, обеспечивая поиск, прием и обработку пищи. Непосредственное отношение к обмену веществ и энергии имеет выделительная система. Таким образом, регуляция обмена веществ и энергии — это мультипарамет-рическая регуляция, включающая в себя регулирующие системы множества функций организма (например, дыхания, кровообращения, выделения, теплообмена и др.).
Роль центра в регуляции обмена веществ и энергии играет гипоталамус. Это обусловлено тем, что в гипоталамусе локализованы нервные ядра и центры, имеющие непосредственное отношение к регуляции голода и насыщения, теплообмена, осморегуляции. В гипоталамусе идентифицированы полисенсорные нейроны, реагирующие сдвигами функциональной активности на изменения концентрации глюкозы, водородных ионов, температуры тела, осмотического давления, т.е. важнейших гомеостатических констант внутренней среды организма. В ядрах гипоталамуса осуществляется анализ состояния внутренней среды организма и формируются управляющие сигналы, которые посредством эфферентных систем приспосабливают ход метаболизма к потребностям организма.
В качестве звеньев эфферентной системы регуляции обмена используется симпатический и парасимпатический отделы вегетативной нервной системы. Выделяющиеся их нервными окончаниями медиаторы оказывают прямое или опосредованное вторичными посредниками влияние на функцию и метаболизм тканей. Под управляющим влиянием гипоталамуса находится и используется в качестве эфферентной системы регуляции обмена веществ и энергии — эндокринная система. Гормоны гипоталамуса, гипофиза и других эндокринных желез оказывают прямое влияние на рост, размножение, дифференцировку, развитие и другие функции клеток. Гормоны принимают участие в поддержании в крови необходимого уровня таких веществ, как глюкоза, свободные жировые кислоты, минеральные ионы (см. главу 5).
Обмен веществ (анаболизм и катаболизм), получение запасаемой в макроэргических связях АТФ энергии, выполнение различных видов работ с использованием метаболической энергии — это, как правило, процессы, протекающие внутри клетки. Поэтому важнейшим эффектором, через который можно оказать регулирующее воздействие на обмен веществ и энергии, является клетка органов и тканей. Регуляция обмена веществ заключается в воздействии на скорость биохимических реакций, протекающих в клетках.
Наиболее частыми эффектами регуляторных воздействий на клетку являются изменения: каталитической активности ферментов и их концентрации, сродства фермента и субстрата, свойств микросреды,
468



 в которой функционируют ферменты. Регуляция активности ферментов может осуществляться различными способами. "Тонкая настройка" каталитической активности ферментов достигается посредством влияния веществ — модуляторов, которыми часто являются сами метаболиты. Этим способом осуществляется регуляция отдельных звеньев метаболических превращений. При этом модулятор может оказывать своей воздействие в отдельной или нескольких тканях организма.
в которой функционируют ферменты. Регуляция активности ферментов может осуществляться различными способами. "Тонкая настройка" каталитической активности ферментов достигается посредством влияния веществ — модуляторов, которыми часто являются сами метаболиты. Этим способом осуществляется регуляция отдельных звеньев метаболических превращений. При этом модулятор может оказывать своей воздействие в отдельной или нескольких тканях организма.
Метаболизм клетки в целом невозможен без интеграции многих биохимических превращений и сама возможность его осуществления определяется энергетическим и окислительно-восстановительным потенциалом клетки. Эта общая интеграция метаболизма обеспечивается, главным образом, с помощью аденилатов, участвующих в регуляции любых метаболических превращений клетки.
Интеграция обмена белков, жиров и углеводов клетки осуществляется посредством общих для них источников энергии. Действительно, при биосинтезе любых простых и сложных органических слоединений, марокмолекул и надмолекулярных структур в качестве общих источников энергии используется АТФ, которая поставляет энергию для процессов фосфорилирования, или НАД • Н, НАДФ • Н, поставляющие энергию для восстановления окислительных соединений. Таким образом, если в клетке осуществлять синтез (анаболизм) определенных веществ, то он может происходить за счет затраты химической энергии одного из общих подвижных источников (АТФ, НАД • Н, НАДФ-Н), которые образуются при катаболизме других веществ (см.рис.10.1).
За общий энергетический запас клетки, полученный в ходе катаболизма и являющийся движущей силой разнообразных превращений, конкурируют все анаболические и другие процессы, протекающие с затратой энергии. Так, например, осуществление глюкоста-тической функции печени, основанной на способности печени синтезировать глюкозу из лактата и аминокислот {глюконеогенез), несовместимо с одновременным синтезом жиров и белков. Глюконеогенез сопровождается расщеплением в печени белков и жиров и окислением образующихся при этом жирных кислот, что ведет к освобождению энергии, необходимой для синтеза АТФ и НАД • Н, в свою очередь требующихся для глюконеогенеза.
Еще одним проявлением интеграции метаболических превращений белков, жиров и углеводов является существование общих предшественников и общих промежуточных продуктов обмена веществ. Это — общий фонд углерода, общий промежуточный продукт обмена- ацетил- КоА и другие вещества. Важнейшими конечными путями превращений, связующими метаболические процессы на различных этапах, являются цикл лимонной кислоты и реакции дыхательной цепи, протекающие в митохондриях. Так, цикл лимонной кислоты — главный источник СО2 для последующих реакций глюконеогенеза, синтеза жирных кислот и мочевины.
Одним из механизмов согласования общих метаболических потребностей организма с потребностями клетки являются нервные и
469



 гормональные влияния на ключевые ферменты. Характерными особенностями этих ферментов являются: положение в начале того метаболического пути, к которому принадлежит фермент; приближенность расположения или ассоциированность со своим субстратом; реагирование не только на действие внутриклеточных регуляторов метаболизма, но и на внеклеточные нервные и гормональные воздействия.
гормональные влияния на ключевые ферменты. Характерными особенностями этих ферментов являются: положение в начале того метаболического пути, к которому принадлежит фермент; приближенность расположения или ассоциированность со своим субстратом; реагирование не только на действие внутриклеточных регуляторов метаболизма, но и на внеклеточные нервные и гормональные воздействия.
Примерами ключевых ферментов являются гликогенфосфорилаза, фосфофруктокиназа, липаза. Их роль в процессах регуляции метаболизма видна, в частности, при подготовке организма к "борьбе или бегству". При повышении в этих условиях в крови уровня адреналина до 10-9 М он связывается с адренорецепторами плазматической мембраны, активирует аденилатциклазу, которая катализирует превращение АТФ в циклический АМФ. Последний активирует гликогенфосфорилазу, многократно усиливающую расщепление гликогена в печени.
Процесс гликогенолиза в мышцах может одновременно активироваться нервной системой и катехоламинами. Этот эффект достигается посредством выделения ионов Са++, его связывания с кальмо-дулином, являющимся субъединицей фосфорилазы, которая при этом активируется и приводит к мобилизации гликогена. Нервный механизм мобилизации гликогена осуществляется через меньшее число промежуточных этапов, чем гормональный. Этим достигается его быстродействие.
Удовлетворение энергетических потребностей организма посредством ускорения внутриклеточных процессов расщепления триглице-ридов в жировой клетчатке достигается активацией гормончувстви-тельной липазы. Повышение активности этого фермента (адреналином, норадреналином, глюкагоном) приводит к мобилизации свободных жирных кислот, являющихся основным энергетическим субстратом окисления в мышцах при выполнении ими интенсивной и длительной работы.
Переход органов и тканей с одного уровня функциональной активности на другой всегда сопровождается соответствующими изменениями их трофики. Например, при рефлекторном сокращении скелетных мышц нервная система осуществляет не только пусковое действие, но и трофическое путем усиления в них местного кровотока и интенсивности обмена веществ. Увеличение силы сокращений миокарда под влиянием симпатической нервной системы обеспечивается одновременным усилением коронарного кровотока и метаболизма в мышце сердца. О влиянии нервной системы на трофику скелетных мышц свидетельствует тот факт, что денервация мышцы приводит к постепенной атрофии мышечных волокон. Важнейшее значение в осуществлении трофической функции нервной системы играет ее симпатический отдел. Через симпато-адреналовую систему достигается не только активация обмена веществ и энергии в клетке, но и создаются дополнительные условия для ускорения метаболизма. Норадреналин и адреналин, выброс которых в кровоток возрастает при возбуждении симпатической нервной системы,
470




 вызывают увеличение глубины дыхания, расширяют мускулатуру бронхов, что способствует доставке кислорода в кровь. Адреналин, оказывая положительное инотропное и хронотропное действие на сердце, увеличивает минутный объем крови, повышает систолическое артериальное давление. В результате активации дыхания и кровообращения возрастает доставка кислорода к тканям.
вызывают увеличение глубины дыхания, расширяют мускулатуру бронхов, что способствует доставке кислорода в кровь. Адреналин, оказывая положительное инотропное и хронотропное действие на сердце, увеличивает минутный объем крови, повышает систолическое артериальное давление. В результате активации дыхания и кровообращения возрастает доставка кислорода к тканям.
Одним из интегральных показателей внутренней среды, отражающим обмен в организме углеводов, белков и жиров, является концентрация в крови глюкозы. Глюкоза является не только энергетическим субстратом, необходимым для синтеза жиров и белков, но и источником их синтеза. В печени происходит новообразование углеводов из жирных кислот и аминокислот.
Нормальное функционирование клеток нервной системы, мышц, для которых глюкоза является важнейшим энергосубстратом, возможно при условии, что приток к ним глюкозы обеспечит их энергетические потребности. Это достигается при содержании в литре крови у человека в среднем 1 г (0,8-1,2 г) глюкозы (рис. 10.3.).
При снижении содержания глюкозы в литре крови до уровня менее 0,5 г, вызванном голоданием, передозировкой инсулина, имеет место недостаточность снабжения энергией клеток мозга. Нарушение их функций проявляется учащением сердцебиения, слабостью и тремором мышц, головокружением, усилением потоотделения, ощущением голода. При дальнейшем снижении концентрации глюкозы в крови указанное состояние, именуемое гипогликемией, может перейти в гипогликемическую кому, характеризующуюся угнетением функций мозга вплоть до потери сознания. Введение в кровь глюкозы, прием сахарозы, инъекция глюкагона предупреждают или ослабляют эти проявления гипогликемии.
Кратковременное повышение уровня глюкозы в крови {гипергликемия) не представляет угрозы для жизни, но может приводить к повышению осмотического давления крови.
В нормальных условиях во всей крови организма содержится около 5 г глюкозы. При среднесуточном потреблении с пищей взрослым человеком, занимающимся физическим трудом, 430 г углеводов в условиях относительного покоя, тканями ежеминутно потребляется около 0,3 г глюкозы. При этом запасов глюкозы в циркулирующей крови достаточно для питания тканей на 3-5 минут и без ее восполнения неминуема гипогликемия. Потребление глюкозы возрастает при физической и психоэмоциональной нагрузках. Так как периодический (несколько раз в день) прием углеводов с пищей не обеспечивает постоянного и равномерного притока глюкозы из кишечника в кровь, в организме существуют механизмы, восполняющие убыль глюкозы из крови в количествах, эквивалентных ее потреблению тканями. Механизмы с другой направленностью действия обеспечивают в нормальных условиях превращение глюкозы в запасаемую форму — гликоген. При уровне более 1,8 г в литре крови происходит выведение ее из организма с мочой.
Избыток глюкозы, всосавшейся из кишечника в кровь воротной вены, поглощается гепатоцитами. При повышении в них концент-
471

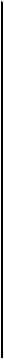

Рис. 10.3 Система регуляции уровня глюкозы в крови (Пояснения в тексте)
472


 рации глюкозы активируется ферменты углеводного обмена печени, превращающие глюкозу в гликоген. В ответ на повышение уровня сахара в крови, протекающей через поджелудочную железу, возрастает секреторная активность В -клеток островков Лангерганса. В кровь выделяется большее количество инсулина — единственного гормона, обладающего резким понижающим концентрацию сахара в крови действием. Под влиянием инсулина повышается проницаемость для глюкозы плазматических мембран клеток мышечной жировой тканей. Инсулин активирует в печени и мышцах процессы превращения глюкозы в гликоген, улучшает ее поглощение и усвоение скелетными, гладкими и сердечной мышцами. Под влиянием инсулина в клетках жировой ткани из глюкозы синтезируются жиры. Одновременно, выделяющийся в больших количествах инсулин тормозит распад гликогена печени и глюконеогенез.
рации глюкозы активируется ферменты углеводного обмена печени, превращающие глюкозу в гликоген. В ответ на повышение уровня сахара в крови, протекающей через поджелудочную железу, возрастает секреторная активность В -клеток островков Лангерганса. В кровь выделяется большее количество инсулина — единственного гормона, обладающего резким понижающим концентрацию сахара в крови действием. Под влиянием инсулина повышается проницаемость для глюкозы плазматических мембран клеток мышечной жировой тканей. Инсулин активирует в печени и мышцах процессы превращения глюкозы в гликоген, улучшает ее поглощение и усвоение скелетными, гладкими и сердечной мышцами. Под влиянием инсулина в клетках жировой ткани из глюкозы синтезируются жиры. Одновременно, выделяющийся в больших количествах инсулин тормозит распад гликогена печени и глюконеогенез.
Содержание глюкозы в крови оценивается глюкорецепторами переднего гипоталамуса, а также его полисенсорными нейронами. В ответ на повышении уровня глюкозы в крови выше "заданного значения" (>1,2 г/л) повышается активность нейронов гипоталамуса, которые посредством влияния парасимпатической нервной системы на поджелудочную железу усиливают секрецию инсулина.
При понижении уровня глюкозы в крови уменьшается ее поглощение гепатоцитами. В поджелудочной железе снижается секреторная активность В -клеток, уменьшается секреция инсулина. Тормозятся процессы превращения глюкозы в гликоген в печени и мышцах, уменьшается поглощение и усвоение глюкозы скелетными и гладкими мышцами, жировыми клетками. При участии этих механизмов замедляется или предотвращается дальнейшее понижение уровня глюкозы в крови, которое могло бы привести к развитию гипогликемии.
При уменьшении концентрации глюкозы в крови имеет место повышении тонуса симпатической нервной системы. Под ее влиянием усиливается секреция в мозговом веществе надпочечников адреналина и норадреналина. Адреналин, стимулируя распад гликогена в печени и мышцах вызывает повышение концентрации сахара в крови. По этому свойству адреналин является наиболее важным антагонистом инсулина среди других гормонов системы регуляции уровня сахара в крови. Например, норадреналин обладает слабовы-раженной способностью повышать уровень глюкозы в крови.
Под влиянием симпатической нервной системы стимулируется выработка а-клетками поджелудочной железы глюкагона, который активирует распад гликогена печени, стимулирует глюконеогенез и приводит к повышению уровня глюкозы в крови.
Понижение в крови концентрации глюкозы, являющейся для организма одним из наиболее важных энергетических субстратов, вызывает развитие стресса. В ответ на снижение уровня сахара крови глюкорецепторные нейроны гипоталамуса через рилизинг-гормоны стимулируют секрецию гипофизом в кровь гормона роста и адрено-кортикотропного гормона. Под влиянием гормона роста уменьшается проницаемость клеточных мембран для глюкозы, усиливается глю-
473


 конеогенез, активируется секреция глюкагона, в результате чего уровень сахара в крови увеличивается. Гормон роста оказывает анаболические эффекты на обмен белков и жиров. Под его влиянием увеличивается содержание белка, снижается количество экс-кретируемого азота, увеличивается концентрация в плазме свободных жирных кислот.
конеогенез, активируется секреция глюкагона, в результате чего уровень сахара в крови увеличивается. Гормон роста оказывает анаболические эффекты на обмен белков и жиров. Под его влиянием увеличивается содержание белка, снижается количество экс-кретируемого азота, увеличивается концентрация в плазме свободных жирных кислот.
Секретируемые под действием адренокортикотропного гормона в коре надпочечников глкжокортикоиды активируют ферменты глюко-неогенеза в печени и этим способствуют увеличению содержания сахара в крови. Одновременно под действием глкжокортикоидов уменьшается включение аминокислот в белки и увеличивается скорость выведения из организма азота. Глкжокортикоиды повышают эффективность липолиза в жировой ткани и мобилизации в кровь свободных жирных кислот.
Регуляция обмена веществ и энергии в целостном организме находится под контролем нервной системы и ее высших отделов. Об этом свидетельствуют факты условнорефлекторного изменения интенсивности метаболизма у спортсменов в предстартовом состоянии, у рабочих перед началом выполнения тяжелой физической работы, у водолазов перед их погружением в воду. В этих случаях увеличивается скорость потребления организмом кислорода, возрастает минутный объем дыхания, минутный объем кровотока, усиливается энергообмен.
Развивающееся при снижении в крови содержания глюкозы, свободных жирных кислот, аминокислот чувство голода обусловливает поведенческую реакцию, направленную на поиск и прием пищи и восполнение в организме питательных веществ.
 2015-02-14
2015-02-14 4112
4112
