Всякая термодинамическая система в любом состоянии обладает внутренней энергией – энергией теплового (поступательного, вращательного и колебательного) движения молекул и потенциальной энергией их взаимодействия.
Возможны два способа изменения внутренней энергии термодинамической системы при ее взаимодействии с внешними телами: путем совершения работы и путем теплообмена.
Известно, что в процессе превращения энергии действует закон сохранения энергии. Поскольку тепловое движение тоже механическое (только не направленное, а хаотическое), то при всех превращениях должен выполняться закон сохранения энергии не только внешних, но и внутренних движений. В этом заключается качественная формулировка закона сохранения энергии для термодинамической системы – первое начало термодинамики. Количественная его формулировка: количество теплоты ΔQ, сообщенное телу, идет на увеличение его внутренней энергии ΔU и на совершение телом работы ΔА, т. е.
Δ Q= ΔU+ ΔA.
Из первого начала термодинамики следует важный вывод: невозможен вечный двигатель первого рода, т. е. такой двигатель, который совершал бы работу «из ничего», без внешнего источника энергии. При наличии внешнего источника часть энергии неизбежно переходит в энергию теплового, хаотического движения молекул, что и является причиной невозможности полного превращения энергии внешнего источника в полезную работу.
Многочисленные опыты показывают, что все тепловые процессы в отличие от механического движения необратимы.
Если реализуется какой-либо термодинамический процесс, то обратный процесс, при котором проходятся те же тепловые состояния, но только в обратном направлении, практически невозможен. Другими словами, термодинамические процессы необратимы.
Приведем два характерных примера необратимых процессов. Если привести в соприкосновение два тела с различной температурой, то более нагретое тело будет отдавать тепло менее нагретому. Обратный процесс – самопроизвольный переход тепла от менее нагретого тела к более нагретому – никогда не произойдет. Столь же необратимым является и другой процесс – расширение газа в пустоту. Газ, находящийся в части сосуда, отдаленной от другой части перегородкой, после ее удаления заполняет весь сосуд. Без постороннего вмешательства газ никогда не соберется самопроизвольно в той же части сосуда, где он находился первоначально.
Всякая предоставленная самой себе система стремится перейти в состояние термодинамического равновесия, в котором тела находятся в состоянии покоя по отношению друг к другу, обладая одинаковыми температурами и давлением. Достигнув этого состояния, система сама по себе из него не выходит. Значит, все термодинамические процессы, приближающиеся к тепловому равновесию, необратимы.
Необратимы и все механические процессы, сопровождающиеся трением. Трение вызывает замедление движения тел, при котором кинетическая энергия переходит в тепло. Замедление эквивалентно приближению к состоянию равновесия, при котором движение тел отсутствует.
В системе тел, находящихся в термодинамическом равновесии, без внешнего вмешательства невозможны никакие реальные процессы. Следовательно, с помощью тел, находящихся в термодинамическом равновесии, невозможно совершить никакой работы, так как работа связана с механическим движением, т. е. с переходом тепловой энергии в кинетическую. Утверждение о невозможности получения работы за счет энергии тел, находящихся в термодинамическом равновесии, лежит в основе второго начала термодинамики.
Окружающая нас среда обладает значительными запасами тепловой энергии. Двигатель, работающий только за счет энергии находящихся в тепловом равновесии тел, был бы для практики вечным двигателем. Второе начало термодинамики исключает возможность создания такого вечного двигателя второго рода.
Необратимость тепловых процессов имеет вероятностный характер. Самопроизвольный переход тела из равновесного состояния в неравновесное не невозможен, а лишь весьма маловероятен. В конечном результате необратимость тепловых процессов обусловливается колоссальностью числа молекул, из которых состоит тело.
Молекулы газа стремятся к наиболее вероятному состоянию, т. е. к состоянию с беспорядочным распределением молекул, при котором примерно одинаковое число молекул движется вверх и вниз, вправо и влево, причем в каждом объеме находятся примерно одинаковое число молекул, одинаковая доля быстрых и медленных молекул в верхней и нижней частях какого-либо сосуда. Любое отклонение от такого беспорядка, хаоса, т. е. от равномерного и беспорядочного перемешивания молекул по местам и скоростям, связано с уменьшением вероятности, или представляет собой менее вероятное событие. Напротив, явления, связанные с перемешиванием, с созданием хаоса из порядка, увеличивают вероятность состояния. Только при внешнем воздействии возможно рождение порядка из хаоса, при котором порядок вытесняет хаос. В качестве примеров, демонстрирующих порядок, можно привести созданные природой минералы, построенные человеком большие и малые сооружения или просто радующие глаз своеобразные фигуры.
Количественной характеристикой теплового состояния тела является число микроскопических способов, с помощью которых это состояние может быть осуществлено. Это число называется статистическим весом состояния (обозначим его буквой Г). Тело, предоставленное самому себе, стремится перейти в состояние с большим статистическим весом.
Принято пользоваться не самим числом Г, а его логарифмом, который еще умножается на постоянную Больцмана k. Определенную таким образом величину
S = k lnГ
называют энтропией тела. Нетрудно убедиться в том, что энтропия сложной системы равна сумме энтропии ее частей.
Второе начало термодинамики, определяющее направление тепловых процессов, можно сформулировать как закон возрастания энтропии:
для всех происходящих в замкнутой системе тепловых процессов энтропия системы возрастает; максимально возможное значение энтропии замкнутой системы достигается в тепловом равновесии:
ΔS 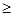 0
0
Данное утверждение принято считать количественной формулировкой второго начала термодинамики (второго закона термодинамики), открытого немецким физиком Р.Ю. Клаузиусом (1822–1888). Молекулярно-кинетическое истолкование этого закона дано австрийским физиком Л. Больцманом (1804– 1906).
Идеальному случаю – полностью обратимому процессу замкнутой системы – соответствует неизменяющаяся энтропия. Все естественные процессы происходят так, что вероятность состояния возрастает, что означает переход от порядка к хаосу. Значит, энтропия характеризует меру хаоса, которая для всех естественных процессов возрастает. В этой связи закон о невозможности вечного двигателя второго рода, закон о стремлении тел к равновесному состоянию получают свое объяснение. Почему механическое движение переходит в тепловое? Да потому, что механическое движение упорядочено, а тепловое беспорядочно, хаотично.
В середине XIX в. активно обсуждалась проблема тепловой смерти Вселенной. Рассматривая Вселенную как замкнутую систему и применяя к ней второе начало термодинамики, Р.Ю. Клаузиус свел его содержание к утверждению, что энтропия Вселенной должна достигнуть своего максимума. Это означает, что все формы движения со временем должны перейти в тепловые. Переход же теплоты от горячих тел к холодным приведет к тому, что температура всех тел во Вселенной сравняется, т. е. наступит полное тепловое равновесие и все процессы во Вселенной прекратятся – наступит тепловая смерть Вселенной. Ошибочность вывода о тепловой смерти заключается в том, что бессмысленно применять второе начало термодинамики к незамкнутым системам, например к такой безграничной и бесконечно развивающейся системе, как Вселенная.
 2015-02-14
2015-02-14 635
635








