Относительная атомная масса (А) химического элемента – отношение массы атома этого элемента к 1/12 массы атома 6С12 (изотопа углерода с массовым числом 12).
Относительная молекулярная масса (М,) вещества – отношение массы молекулы этого вещества к 1/12 массы атома 6С12.
Относительные атомная и молекулярная массы являются величинами безразмерными. Масса, равная 1/12 массы 6С12, называется атомной единицей массы (а.е.м.). 1 а.е.м. = 1,66*10–27 кг.
Моль - количество вещества, в котором содержится число частиц (атомов, молекул, ионов, электронов или других структурных единиц), равное числу атомов в 0,012 кг изотопа углерода 6С12.
Число частиц, содержащихся в 1 моле вещества, называется постоянной Авогадро NA. Численное значение постоянной Авогадро – NA = 6,02*1023 моль–1.
Молярная масса (μ) – масса одного моля. μ измеряется в кг/моль. Молярная масса и относительная молекулярная масса связаны соотношением:
μ = М * 10–3 (кг/моль) (1)
Число молей, содержащихся в массе m вещества, определяется формулой:
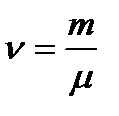 (2)
(2)
Если вещество представляет собой смесь, то молярная масса смеси рассчитывается как отношение массы смеси к количеству вещества всех компонентов, входящих в состав этой смеси:
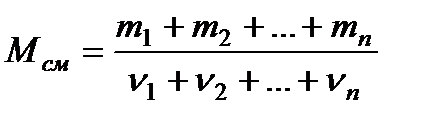 (3)
(3)
где n – число компонентов.
Размеры атомов и молекул принято характеризовать эффективным диаметром dэф, зависящим от химической природы вещества (dэф ~ 10–10 м).
Эффективный диаметр – это наименьшее расстояние, на которое сближаются центры двух молекул при столкновении. Его наличие говорит о том, что между молекулами действуют силы взаимного отталкивания.
 2015-02-15
2015-02-15 2694
2694
