Параметры состояния идеального газа связаны между собой соотношением:
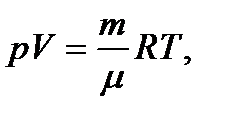 (5)
(5)
где p – давление, производимое газом,
m – масса газа,
μ – молярная масса,
T – термодинамическая температура,
R = 8,31 Дж/(моль*К) – универсальная газовая постоянная.
газовая постоянная.
Уравнение (5) называется уравнением состояния идеального газа или уравнением Менделеева-Клапейрона. Как видим, для того, чтобы определить состояние газа, достаточно знать значение двух любых параметров. Третий параметр однозначно вычисляется из уравнения (5).
Уравнение (5) можно свести к виду:
р = nkT. (6)
Величина k = R/NA =1,38*10–23 Дж/К называется постоянной Больцмана. NA – число Авогадро. Величина n = N/V – дает число молекул в единице объема и называется концентрацией молекул.
Из (6) следует, что давление идеального газа пропорционально его абсолютной температуре и концентрации молекул.
Если имеется несколько газов, то давление, производимое газом, будет равно:
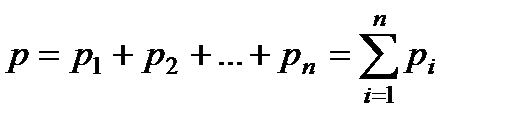 (7)
(7)
где p1 — давление, которое было бы в сосуде, если бы в нем находились только молекулы первого газа; p2 —давление, которое было бы при наличии в сосуде только молекул второго газа и т.д.
Давление, которое производил бы газ, при условии, что он один присутствует в сосуде в том количестве, в каком он содержится в смеси, называется парциальным.
Уравнение (7) представляет собой закон Дальтона:
 2015-02-15
2015-02-15 1046
1046
