Рассмотрим газовую смесь, состоящую из нескольких компонент, т. е. из молекул нескольких сортов. Число молекул i-й компоненты в единице объема обозначим ni. Полное число молекул в единице объема будет равно
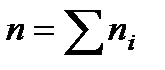 .
.
Относительной концентрацией i -й компоненты в смеси называется безразмерная величина
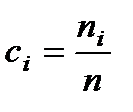 .
.
Очевидно, что сумма относительных концентрацийвсех компонент равна единице:
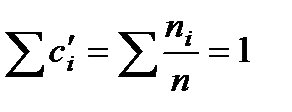 .
.
Абсолютной концентрацией какой-либо компоненты называется масса молекул данного сорта, содержащаяся в единице объема. Определенная таким образом концентрация представляет собой парциальную плотность данной компоненты. Если масса молекулы i -й компоненты mi, то абсолютная концентрация будет равна
ci = nimi.
Давление газовой смеси равно сумме парциальных давлений отдельных компонент и определяется полным числом молекул в единице объема:
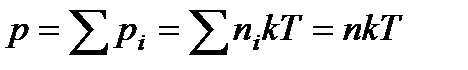 .
.
Может случиться, что концентрация газовых компонент в различных точках пространства будет неодинакова. В этом случае вследствие теплового движения молекул будет происходить процесс выравнивания концентраций, сопровождающийся переносом массы i -й компоненты в направлении убывания ее концентрации. Этот процесс носит название диффузии.
Полное число молекул, а следовательно, и давление в процессе диффузии не изменяются. Происходит лишь перераспределение молекул разных сортов, т. е. изменение величин ni, причем таким образом, что возрастание в каком-то месте ni для одной из компонент сопровождается одновременным изменением ni для других компонент, так что сумма ni остается постоянной.
В дальнейшем в этом параграфе будет идти речь о двухкомпонентных газовых смесях.
Предположим, что в некотором объеме каким-то образом поддерживается не изменяющийся со временем градиент концентраций обеих компонент вдоль направления z (рис. 31, на котором вместо абсолютных концентраций изображены пропорциональные им числа молекул в единице объема). Давление во всем объеме одинаково. Следовательно, сумма n1 + п2 в каждом сечении будет одна и та же. В этом случае через перпендикулярную к z площадку S устанавливается преимущественный поток молекул первого сорта в направлении слева направо, который можно охарактеризовать величиной массы М1 переносимой через S за одну секунду. Опыт дает, что эта величина определяется следующим выражением:
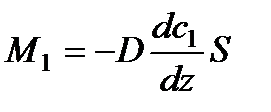 , (69)
, (69)
где D – коэффициент пропорциональности, называемый коэффициентом диффузии, 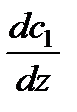 — градиент абсолютной концентрации в том сечении, где мы мысленно расположили площадку S.
— градиент абсолютной концентрации в том сечении, где мы мысленно расположили площадку S.
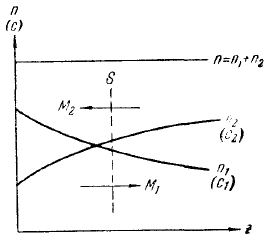
Рис. 31. К вычислению коэффициента диффузии
Масса, переносимая через площадку S за время t, очевидно, равна
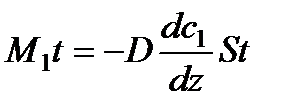 . (70)
. (70)
Одновременно будет существовать встречный поток молекул второго сорта, определяемый аналогичным выражением
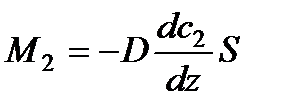 .
.
Уравнение (70) представляет собой эмпирическое уравнение диффузии. Знак «—» показывает, что масса переносится в направлении убывания концентрации данной компоненты.
Получим уравнение диффузии, основываясь на молекулярно-кинетических представлениях, причем для упрощения расчетов мы будем считать, что молекулы обеих компонент мало отличаются по массе (т1 ≈ т2 ≈ т) и имеют практически одинаковые эффективные сечения (σ1 ≈ σ2 ≈ σ). В этом случае молекулам обеих компонент можно приписывать одинаковую среднюю скорость теплового движения v, а среднюю длину свободного пробега вычислять по формуле
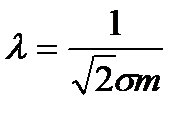 ,
,
где п = n1 + n2.
Пусть изменение концентрации первой компоненты вдоль оси z дается функцией с1 = с1(z). Каждая молекула, пролетающая через площадку S, переносит присущую ей массу т (напомним, что т1 ≈ т). Обозначим количество молекул первой компоненты, пролетающих за секунду через S в направлении оси z, через 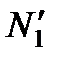 , тоже число для направления, противоположного z, — через
, тоже число для направления, противоположного z, — через 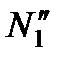 .
.
Тогда масса первой компоненты, переносимая за секунду в направлении z, может быть представлена в виде
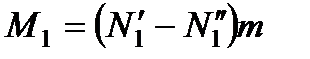 . (71)
. (71)
Как и в предыдущих случаях, можно считать, что пересекающие площадку S молекулы прилетают из сечений, отстоящих от S на среднюю длину свободного пробега. Тогда количество молекул, пролетающих через S в направлении оси z, будет определяться значением числа молекул в единице объема 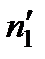 , отвечающим сечению с координатой z – λ, а количество молекул, летящих в противоположном направлении, —
, отвечающим сечению с координатой z – λ, а количество молекул, летящих в противоположном направлении, — 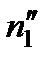 , отвечающим сечению с координатой z + λ. Таким образом, числа
, отвечающим сечению с координатой z + λ. Таким образом, числа 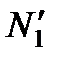 и
и 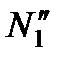 определяются выражением
определяются выражением
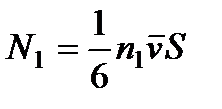 ,
,
где для 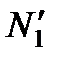 должно быть взято число
должно быть взято число 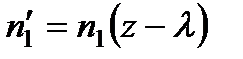 , а для
, а для 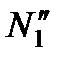 — число
— число 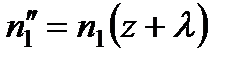 . Подставляя значения
. Подставляя значения 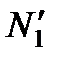 и
и 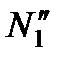 в (71), получаем:
в (71), получаем:
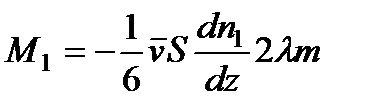 .
.
Поскольку т — постоянная величина, выражение 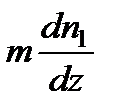 можно записать в виде
можно записать в виде
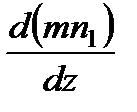 , что представляет собой градиент концентрации
, что представляет собой градиент концентрации 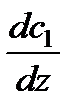 . Тогда
. Тогда

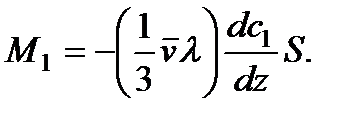 (72)
(72)
Сопоставляя (72) и (70), получаем газокинетическое выражение для коэффициента диффузии:
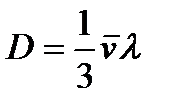 . (73)
. (73)
Отсюда вытекает, что размерность D равна м2/с.
Проведенные нами рассуждения в равной мере применимы к обеим компонентам смеси. Следовательно, коэффициент диффузии для обеих компонент имеет одинаковое значение.
Сравнивая (73) с (59), получаем следующую связь между η и D:
η = ρD.
Подставив в (73) выражение для 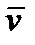 и λ, получаем:
и λ, получаем:
D ~ 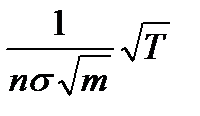 .
.
В отличие от η и κ коэффициент диффузии оказывается обратно пропорциональным числу молекул в единице объема, а следовательно, и давлению p. Зависимость от температуры у D такая же, как у η и κ.
Для смеси молекул различной массы и сечения соответствующий расчет дает следующее выражение коэффициента диффузии:
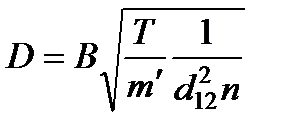 ,
,
где B – числовой коэффициент, 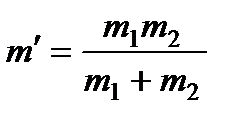 – так называемая приведенная масса молекул и
– так называемая приведенная масса молекул и 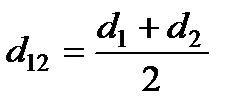 – полусумма эффективных диаметров.
– полусумма эффективных диаметров.
 2015-02-15
2015-02-15 1042
1042
