| Вещество | l, Вт/м/К | Вещество | l, Вт/м/К |
| Серебро | Кирпич изоляционный | 0,14 | |
| Медь | Асбест листовой | 0,12 | |
| Алюминий | Шлаковая вата | 0,07 | |
| Латунь | Аммиак | 0,570 | |
| Чугун | Вода | 0,547 | |
| Накипь котельная | 1,3…3,1 | Воздух | 0,024 |
| Бетон | 1,28 | Углекислый газ | 0,017 |
 Коэффициент
Коэффициент 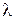 , как и
, как и 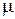 , зависит от вида газа и температуры. При увеличении температуры
, зависит от вида газа и температуры. При увеличении температуры 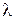 растет. При высоких температурах коэффициент теплопроводности реального газа
растет. При высоких температурах коэффициент теплопроводности реального газа 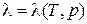 .
.
Рассмотрим процесс переноса тепла с точки зрения молекулярно-кинети-ческой теории (рис. 1.3). Количество тепла, переносимое единицей массы, равно 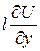 , где U – внутренняя энергия единицы массы газа.
, где U – внутренняя энергия единицы массы газа.
Масса молекул, пересекающих при своем движении поверхность с единичной площадью, равна 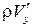 , где
, где 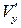 – собственная скорость молекул, т. е. через единичную площадку в единицу времени переносится энергия (количество тепла), равная
– собственная скорость молекул, т. е. через единичную площадку в единицу времени переносится энергия (количество тепла), равная
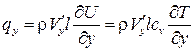 , (1.6)
, (1.6)
так как 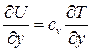 . Сравнивая формулы (1.5) и (1.6), можно сделать вывод, что
. Сравнивая формулы (1.5) и (1.6), можно сделать вывод, что 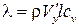 . Таким образом, коэффициент l пропорционален скорости хаотического движения молекул, являющейся функцией температуры газа, поэтому
. Таким образом, коэффициент l пропорционален скорости хаотического движения молекул, являющейся функцией температуры газа, поэтому 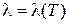 .
.
При температурах до 2 000 К коэффициент теплопроводности можно определить через коэффициент динамической вязкости по следующей формуле:
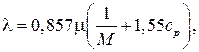
где 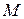 – молекулярный вес данного сорта газа.
– молекулярный вес данного сорта газа.
Параметры состояния газа
Вспомним объединенный газовый закон 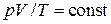 (
(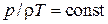 ), или уравнение Менделеева–Клапейрона – уравнение состояния идеального газа:
), или уравнение Менделеева–Клапейрона – уравнение состояния идеального газа:
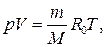 или
или 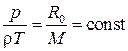 .
.
Важнейшими характеристиками состояния газа являются давление 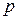 , плотность
, плотность 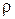 и температура
и температура 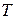 .
.
В общем случае при движении газа эти параметры меняются при переходе от точки к точке и зависят от времени. Для термодинамически совершенного газа 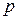 ,
, 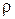 ,
, 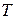 связаны указанным уравнением Клапейрона. Во многих реальных практических случаях эта связь выражается более сложно. Для реальных газов нельзя пренебрегать собственным объемом молекул и силами взаимодействия между ними. Эти факторы сказываются тем сильнее, чем выше давление.
связаны указанным уравнением Клапейрона. Во многих реальных практических случаях эта связь выражается более сложно. Для реальных газов нельзя пренебрегать собственным объемом молекул и силами взаимодействия между ними. Эти факторы сказываются тем сильнее, чем выше давление.
Таким образом, для неустановившегося движения параметры состояния газа являются функциями координат и времени:
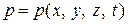 ,
, 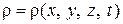 ,
, 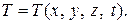
Давление. Если скорость движения жидкости V = 0, то касательные напряжения отсутствуют и в жидкости имеются только напряжения сжатия – аэродинамическое давление.
Выделим в жидкости бесконечно малый тетраэдр (рис. 1.4), в котором 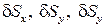 есть плоскости граней тетраэдра, перпендикулярных к осям
есть плоскости граней тетраэдра, перпендикулярных к осям 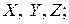
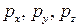 – давление на этих гранях;
– давление на этих гранях; 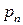 и
и 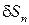 – давление и плоскость наклонной грани, взятой произвольно.
– давление и плоскость наклонной грани, взятой произвольно.
 Силы, действующие на рассматриваемый объем жидкости, разделяются на поверхностные – силы давления на грани
Силы, действующие на рассматриваемый объем жидкости, разделяются на поверхностные – силы давления на грани 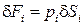 и объемные – массовая сила
и объемные – массовая сила 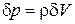 .
.
Так как объем тетраэдра 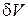 есть величина третьего порядка малости, а
есть величина третьего порядка малости, а 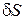 – второго порядка, то при стягивании тетраэдра в точку массовой силой можно пренебречь.
– второго порядка, то при стягивании тетраэдра в точку массовой силой можно пренебречь.
Уравнение равновесия тетраэдра в проекции на ось ОX запишется как 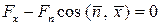 , или
, или 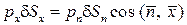 . Поскольку
. Поскольку 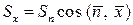 , то
, то 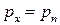 . Аналогичные результаты получаются для проекций на оси OY и OZ.
. Аналогичные результаты получаются для проекций на оси OY и OZ.
Следовательно, так как координатные плоскости выбраны произвольно, то 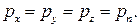
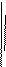 Давление в любой точке покоящейся жидкости остается постоянным для всех площадок, проходящих через эту точку, т. е. не зависит от ориентации площадки, на которую оно действует.
Давление в любой точке покоящейся жидкости остается постоянным для всех площадок, проходящих через эту точку, т. е. не зависит от ориентации площадки, на которую оно действует.
Единицы измерения давления следующие: в системе СИ 1 Па = 1 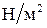 ; в технической системе 1 ат =
; в технической системе 1 ат = 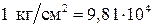 Па.
Па.
Плотность. Массовая плотность характеризует распределение массы в среде. Для среды, сплошь заполняющей пространство, плотность есть функция координат точки. Массовая плотность жидкости или газа определяется как 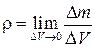 .
.
Для прерывистой среды этот предел мог бы и не существовать. При величине 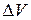 , сравнимой с молекулярными размерами, непрерывное изменение
, сравнимой с молекулярными размерами, непрерывное изменение 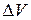 привело бы к прерывистому изменению
привело бы к прерывистому изменению 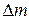 . Приняв гипотезу сплошности среды, можно быть уверенным, что предел существует всегда.
. Приняв гипотезу сплошности среды, можно быть уверенным, что предел существует всегда.
Единица измерения плотности – 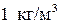 . Например, при нормальных условиях (
. Например, при нормальных условиях (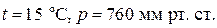 ) плотность воды равна
) плотность воды равна 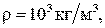 а плотность воздуха
а плотность воздуха 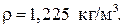 Для газов плотность является функцией давления и температуры,
Для газов плотность является функцией давления и температуры, 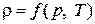 , а для несжимаемых жидкостей – только температуры,
, а для несжимаемых жидкостей – только температуры, 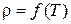 .
.
Непосредственное измерение плотности движущейся сжимаемой среды затруднено, поэтому 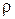 обычно определяют косвенным путем. Так для совершенных газов плотность определяют с помощью уравнения Менделеева–Клапейрона, для изотермических процессов (
обычно определяют косвенным путем. Так для совершенных газов плотность определяют с помощью уравнения Менделеева–Клапейрона, для изотермических процессов (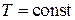 ) – по уравнению
) – по уравнению 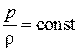 , для адиабатических процессов – по уравнению
, для адиабатических процессов – по уравнению 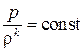 , где
, где 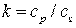 – показатель адиабаты, величина которого зависит от молекулярного строения данного сорта газа; для двухатомных газов k = 1,4.
– показатель адиабаты, величина которого зависит от молекулярного строения данного сорта газа; для двухатомных газов k = 1,4.
Температура. Температура есть мера внутренней энергии жидкости или газа и вообще любого тела. По величине температуры судят о степени нагретости, т. е. о тепловом состоянии тела. При наличии теплопроводности температура различных частей тела от точки к точке меняется непрерывно. Непрерывность изменения температуры возможна только в сплошных средах. Если же элементарный объем сравним с молекулярными размерами, то 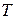 – прерывистая функция (в межмолекулярном объеме температура равна нулю). Поскольку скорость хаотического движения молекул зависит от температуры, то
– прерывистая функция (в межмолекулярном объеме температура равна нулю). Поскольку скорость хаотического движения молекул зависит от температуры, то 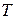 является мерой кинетической составляющей внутренней энергии.
является мерой кинетической составляющей внутренней энергии.
Если 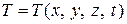 , то мы имеем дело с неустановившимся (нестационарным) полем температур, если
, то мы имеем дело с неустановившимся (нестационарным) полем температур, если 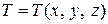 , то поле температур стационарное (установившееся).
, то поле температур стационарное (установившееся).
В настоящее время на равных правах существуют и применяются температурные шкалы Цельсия и Кельвина. Единица измерения температуры по шкале Цельсия – градус  , по шкале Кельвина – К (Кельвин). Переход от шкалы Цельсия к шкале Кельвина осуществляется следующим образом:
, по шкале Кельвина – К (Кельвин). Переход от шкалы Цельсия к шкале Кельвина осуществляется следующим образом: 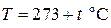 (К).
(К).
 2015-03-22
2015-03-22 706
706








