Электрохимическая коррозия металлов, при которой катодный процесс осуществляется молекулами кислорода, растворенного в электролите, называется коррозией с кислородной деполяризацией. Согласно термодинамике электродных, процессов, коррозия металла с кислородной деполяризацией возможна, если
(Е Ме)обр < (E O2)обр (49)
где (Е Ме)обр и (E O2)обр – обратимые потенциалы металла и кислородного электрода в данных условиях, выраженные в вольтах. Обратимый потенциал кислородного электрода определяется выражением
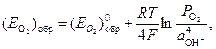
в котором (E O2)обр0 = +0,401 В – стандартный потенциал кислородного электрода (при P O2 = 1 атм, a OH- = 1 и Т = 298 К); P O2 – парциальное давление кислорода, выраженное в атмосферах, a OH- - активность гидроксид-ионов в растворе.
В силу достаточно положительных значений (E O2)обр в воде, нейтральных водных растворах солей, грунте, атмосфере и других средах условие (49) для многих металлов выполняется, и их коррозия протекает с кислородной деполяризацией.
Катодный процесс кислородной деполяризации включает ряд последовательных стадий:
1) растворение кислорода воздуха в электролите;
2) перенос растворенного кислорода в объеме электролита и части слоя Прандтля в результате естественной конвекции или дополнительного перемешивания раствора;
3) диффузионный перенос кислорода в диффузионном слое или в пленке продуктов коррозии к катодным участкам поверхности корродирующего металла;
4) ионизацию кислорода:
в нейтральных и щелочных растворах
O2 + 4e +2H2O = 4OH-; (50)
в кислых растворах
O2 + 4e + 4H+ = 2H2O; (51)
5) диффузию и конвективный перенос ионов OH- от катодных участков метала в объеме раствора.
Наиболее затрудненной стадией катодного процесса коррозии металлов с кислородной деполяризацией в спокойных электролитах является диффузия кислорода, а при интенсивном подводе кислорода к поверхности металла – электрохимическая реакция ионизации кислорода. Часто замедленности этих стадий оказываются соизмеримыми.
Электрохимическую поляризацию (Δ E к)эх (сдвиг потенциала катода в отрицательном направлении под действием постоянного тока) вследствие замедленности реакции кислородной деполяризации называют перенапряжением ионизации кислорода:
Θ = (Δ E к)эх = (E O2)обр – E к, (52)
где E к – эффективный потенциал катода, В.
С увеличением силы тока, протекающего через катод, перенапряжение ионизации кислорода возрастает. При малых плотностях тока (i к < 10-2 А/м2) оно прямо пропорционально i к
Θ = k 2 i к, (53)
где k 2 – постоянная. При больших плотностях тока зависимость перенапряжения от i к передается уравнением Тафеля:
Θ = a 2 + b 2lg i к, (54)
в котором a 2 и b 2 являются константами.
Поскольку постоянные k 2 и a 2 в уравнениях (53) и (54) зависят от материала и состояния поверхности катода, температуры и ряда других параметров, а константа b 2 связана с механизмом возникновения перенапряжения, то в общем случае величина перенапряжения ионизации кислорода определяется всеми перечисленными факторами.
Если перенапряжение вызвано замедленностью элементарной реакций ассимиляции электронов деполяризатором, то b 2 = 2 RT / nF ·2,303.
Малая растворимость кислорода в водных растворах, его низкая диффузионная подвижность в приэлектродном слое электролита и пленке вторичных труднорастворимых продуктов коррозии приводят к возникновению концентрационной политизации катода (Δ E к)конц, которая может быть рассчитана по уравнению
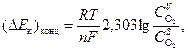 (55)
(55)
где n – число электронов, участвующих в ионизации одной молекулы кислорода, C O2 V и C O2 S – концентрации кислорода в объеме и у поверхности электрода (моль/см3) соответственно. Зависимость (Δ E к)конц от плотности катодного тока в соответствии с уравнением (8) имеет вид
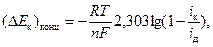 (56)
(56)
где i к – катодная плотность тока, i д – предельная диффузионная плотность тока по кислороду, определяемая выражением
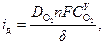 (57)
(57)
в котором D O2 – коэффициент диффузии кислорода в данном растворе (см2/с) при температуре Т; δ – эффективная толщина диффузионного слоя, см.
Перемешивание и повышение температуры электролита приводит к увеличению диффузионной подвижности кислорода и, следовательно, уменьшению концентрационной поляризации.
Поскольку в общем случае поляризация катода представляет собой сумму электрохимического и концентрационного вкладов, ее зависимость от плотности катодного тока носит сложный характер (рис. 7) и определяется выражением:
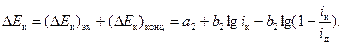 (58)
(58)
По мере увеличения плотности тока происходит переход от линейной зависимости (53) к логарифмической (54) и усиление вклада (Δ E к)конц, вследствие чего суммарная катодная кривая ACD идет круче, чем кривая AB, отвечающая только электрохимической поляризации. При дальнейшем увеличении плотности тока концентрационный вклад становится определяющим, и по достижении i к = i д на суммарной кривой катодной поляризации наблюдается практически вертикальный участок DE.
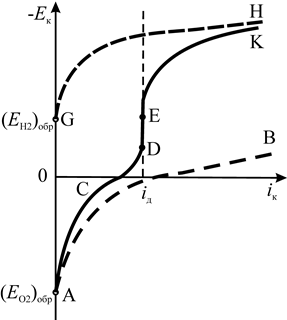
Рис. 7. Катодная кривая смешанной кислородно-водородной деполяризации
В водных растворах при определенном смещении Е к в отрицательном направлении (до (E H2)обр в данных условиях) становится возможной реакция водородной деполяризации (кривая GH), накладывающаяся на процесс кислородной деполяризации, что приводит к дополнительному возрастанию катодного тока (участок EK). Таким образом, общая идеальная кривая катодной поляризации (E О2)обр ACDEK характеризует протекание катодного процесса на исследуемом металле в данных условиях.
Экспериментально снимаемые (реальные) катодные поляризационные кривые заметно отличаются от приведенной идеальной кривой, что обусловлено коррозией исследуемого образца-электрода. Например, начальные (в отсутствии тока) потенциалы металлов, корродирующих в 1 %-ном растворе NaCl с кислородной деполяризацией, находятся между (E О2)обр и (E а)обр = (E Ме)обр в данных условиях и могут быть использованы для расчета степени контроля (анодного и катодного) коррозионного процесса. Для платины, практически не корродирующей в 1 %-ном растворе NaCl, реальная катодная поляризационная кривая наиболее близка к идеальной. В частности абсцисса точки перегиба Е на вертикальном участке катодной кривой для платины фактически совпадает с истинной предельной диффузионной плотностью тока.
 2015-03-22
2015-03-22 472
472








