Пассивность – это состояние относительно высокой коррозионной стойкости, вызванное торможением анодной реакции ионизации металла в определенной области потенциала.
Наступление пассивности (пассивации) обусловлено образованием защитной пленки продукта коррозии – чаще оксидной или гидроксидной природы. Наряду с торможением анодной реакции могут существенно уменьшаться возможности протекания катодного процесса при образовании слоев с низкой электропроводностью, а также за счет анодной поляризации. Пассивность металла при анодной поляризаций (анодная пассивность) является следствием электрохимического образования адсорбционных или фазовых слоев на поверхности. Иногда торможение скорости коррозии металла обусловлено хемосорбцией малых количеств кислорода (доли монослоя – например, железо в растворах NaOH, или всего несколько процентов от монослоя – платина в растворе HCl).
Пассивность наблюдается в определенных условиях на очень многих металлах, в том числе таких технически важных как титан, хром, алюминий, молибден, магний, никель, кобальт, железо и другие.
Наступление пассивного состояния характеризуется значительным уменьшением скорости коррозии металла и заметным смещением его потенциала в положительную область.
Пассивирующими факторами, вызывающими в определенных условиях наступление пассивного состояния металлов, являются:
1) окислители, например, HNO3, NaNO3, NaNO2, K2Cr2O7, O2 и др.;
2) анодная поляризация (смещение потенциала металла в положительную область значений) от внешнего источника тока или в контакте с более электроположительным металлом.
Пассивность зависит от внутренних (состав, структура и состояние поверхности металла) и от внешних факторов (состав и концентрация электролита, температура, движение раствора, наложение постоянного тока и т.д.).
О большей или меньшей склонности металла к пассивированию можно судить по пассивирующей концентрации окислителя или пассивирующей анодной плотности тока. Например, железо начинает пассивироваться в разбавленной серной кислоте при плотности анодного тока i нп = 200-300 мА/см2 (рис. 10), тогда как для хрома эта величина на 3-4 порядка меньше, что соответствует значительно более высокой пассивируемости хрома. Устойчивость пассивности определяется величиной плотности анодного тока i пп в пассивном состоянии и шириной пассивной области.
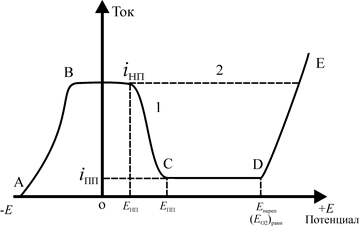
Рис. 10. Анодная поляризационная кривая железа в растворе H2SO4
В работе используют два метода анодной поляризации - потенцио- и гальваностатический. Поляризационная кривая (см. рис. 10, кривая 1), получаемая первым из них, позволяет выделить области: активного растворения (AB), пассивности (CD) и перепассивации, сопровождаемой выделением кислорода (DE). В гальваностатическом методе нельзя фиксировать торможение по падению силы тока, как в потенциостатическом методе (BD) – оно проявляется лишь в резком сдвиге потенциала в положительную сторону (см. рис. 10, кривая 2), и область пассивности достигается при обратном изменении (уменьшении) силы тока (EDC).
 2015-03-22
2015-03-22 980
980








