При определенной температуре в системе N2 + 3H2 Û 2NH3 установилось равновесие при следующих концентрациях: N2 - 0,1моль/л, H2 - 0,15 моль/л, NH3 - 0,02 моль/л. Найдите константу равновесия этой реакции и начальные концентрации исходных веществ. Найдите концентрацию азота в другой равновесной смеси при той же температуре, если концентрация в ней Н2 - 0,2 моль/л, а NH3 - 0,03 моль/л.
Решение: Запишем уравнение реакции и выразим Кр в общем виде: N2 + 3H2 Û 2NH3, Кр = 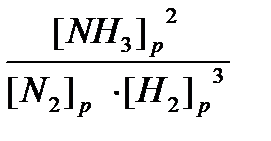 .
. 
Найдем константу равновесия для первой смеси
Кр = 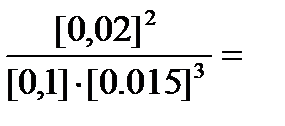 1,185.
1,185.
Зная константу равновесия можно определить концентрацию азота во второй смеси [N2]  =
= 
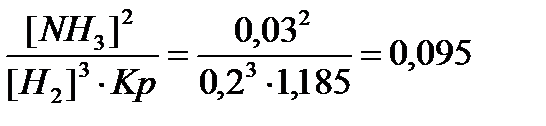 моль/л
моль/л
По уравнению реакции можно определить начальные концентрации исходных веществ: х моль y моль 0,02 моль
N2 + 3H2 Û 2NH3
По уравнению реакции 2 моль NH3образуется из 1моль N2 и 3 моль H2
Составим пропорцию по уравнению и найдем количества молей N2 и H2 пошедших на образование 0,02 моля NH3
х = 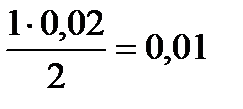 моль N2 (расход), y =
моль N2 (расход), y = 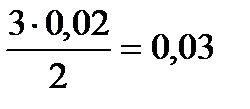 моль/л H2 (расход)
моль/л H2 (расход)
Начальные концентрации были:
С0(N2) = Ср(N2) + Срасход(N2) = 0,1+ 0,01 = 0,11 моль/л
С0(Н2) = Ср(Н2) + Срасход(Н2) = 0,15+ 0,03 = 0,18 моль/л
Рекомендуемая литература: [1], с.186-210; [2], с. 149-203.
 2015-03-07
2015-03-07 484
484








