Химическое равновесие – это динамическое состояние системы, при котором скорости прямой и обратной реакции равны, то есть сколько молекул продукта реакции образуется в единицу времени, столько же и расходуется на обратную реакцию.
Для того чтобы показать, насколько полно протекает прямая реакция до момента установления химического равновесия, используют константу равновесия реакции – Кр, которая численно равна произведению равновесных концентраций продуктов реакций в степенях, равных стехиометрическим коэффициентам, поделенному на произведение равновесных концентраций исходных веществ в соответствующих степенях.
Если записать уравнение реакции в виде:
nA + mB Û pC + gD, то Kp = 
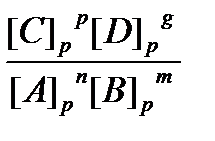 , где [C]р, [D]р, [A]р , [B]р –равновесные концентрации веществ. Выражение выведено из закона действующих масс при условии V® = V.
, где [C]р, [D]р, [A]р , [B]р –равновесные концентрации веществ. Выражение выведено из закона действующих масс при условии V® = V.
В формуле учитываются только газообразные и растворенные вещества (если реакция идет в растворе).
Чем больше Кр, тем полнее идет прямая реакция. Если Кр > 1, то на момент установления равновесия большая часть исходных веществ превратилась в продукты; если Кр < 1, в продукты превратилась меньшая часть исходных веществ. Кр зависит от температуры и не зависит от концентрации исходных веществ.
Чтобы реакция на химических производствах проходила как можно полнее, необходимо сместить равновесие в сторону продукта.
Для того чтобы определить, как тот или иной фактор изменит равновесие в системе, используют принцип Ле-Шателье (1844г):
Если на систему, находящуюся в состоянии равновесия, оказывает влияние внешний фактор ( температура, давление, концентрации исходных веществ и продуктов реакции), то равновесие смещается в сторону уменьшения этого воздействия.
Катализатор не влияет на смещение равновесия, так как одинаково ускоряет как прямую, так и обратную реакции, с помощью катализатора можно ускорить момент наступления равновесия.
Для того, чтобы определить как внешнее воздействие повлияет на равновесие, нужно знать, как сама реакция изменяет свои параметры.
Например О2 + 2SO2 Û 2SO3 + Q
Прямая реакция:
а) повышает температуру (+Q)
б) понижает давление (до реакции 2+1 моль газов, после реакции - 2 моль газов);
в) концентрации исходных веществ снижает;
г) концентрацию продукта увеличивает
Значит, все противоположные воздействия: понижение температуры, повышение давления, повышение концентраций исходных веществ, выведение из системы продукта, будут способствовать смещению равновесия в сторону прямой реакции.
 2015-03-07
2015-03-07 564
564








