| вос-ль |
| ок-ль |
среда
Определим степень окисления элементов в соединениях. Степень окисления у марганца +7 (наивысшая, соответствующая номеру группы в ПСЭ), следовательно, Мn+7может проявлять только окислительные свойства. Наиболее устойчивой в кислой среде для марганца является степень окисления +2. Сера в сероводороде имеет степень окисления -2, т.е. низшую. Следовательно, S-2 может проявлять только восстановительные свойства, и переходит в следующую степень окисления, равную нулю.
Окислитель Mn+7 + 5e ® Mn+2 2 процесс восстановления
Восстановитель S-2 -2е –2e ® S0 5 процесс окисления
Коэффициент 2 - для окислителя, 5 - для восстановителя, так как количество электронов отданных восстановителем (-2е ·5 =-10е), должно равняться количеству электронов, принятых окислителем(+5е ·2 =+10е).
По правой части электронного баланса пишем предполагаемые продукты реакции:
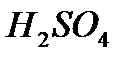
Mn+2 ® MnO ® Mn(OH)2 à MnSO4.
Свободная сера выпадает в осадок, калий при обмене со средой образует K2SO4, а водород и кислород не участвующие в передаче электронов, образуют воду. Расставляем коэффициенты согласно балансу:
2KMnO4 + 5H2S + 3H2SO4 ® 2MnSO4 + 5S¯ + K2SO4 + 8H2O
 2015-03-07
2015-03-07 954
954








