Термодинамика изучает законы, которые описывают обмен энергией между изучаемой системой и внешней средой и в частности, превращение тепловой энергии в другие формы энергий, а также направление самопроизвольного течения различных процессов в данных условиях.
При химических реакциях происходят глубокие качественные изменения в системе, рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии. В большинстве случаев этой энергией является теплота. Раздел термодинамики, изучающий тепловые эффекты химической реакции, называется термохимией. Реакции, которые сопровождаются выделением теплоты, называются экзотермическими, а те, которые сопровождаются поглощением теплоты — эндотермическими. Таким образом, теплоты реакций являются мерой изменения свойств системы, и знание их может иметь большое значение при определении условий протекания тех или иных реакций.
Термодинамическая система – одно из основных понятий термодинамики. Это часть пространства, выделенная для теоретического и экспериментального изучения с позиций энергообмена и массообмена с внешней средой. Система может быть отделена от внешней среды реальной или воображаемой границей. Если через границу может осуществляться обмен веществом и энергией между системой и внешней средой, то система называется открытой. К таким системам относятся все живые организмы, многие производственные процессы. В закрытых системах происходит только обмен энергией (запаянная ампула, грелка и др.). Если невозможен обмен ни веществом, ни энергией, то система называется изолированной (термос в первом приближении, вселенная).
Энергия химической реакции возникает за счет изменения в системе внутренней энергии U, либо энтальпии Н.
Внутренняя энергия системы U - это общий ее запас, включающий энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных трупп, энергию движения электронов, внутриядерную энергию и т. д.
Внутренняя энергия - это полная энергия системы без потенциальной, обусловленной положением системы в пространстве, и без кинетической энергии системы как целого. Абсолютное значение внутренней энергии веществ (U) неизвестно, так как нельзя привести систему в состояние, лишенное энергии. Внутренняя энергия, как и любой вид энергии, является функцией состояния, то есть ее изменение однозначно определяется начальным и конечным состоянием системы и не зависит от пути перехода, по которому протекает процесс, ∆U = U2 - U1, где ∆U - изменение внутренней энергии системы при переходе от начального состояния (Ul) в конечное U2. Если U2> U1, то ∆U > О. Если Ul>U2, то ∆U < О.
Величины, позволяющие определить состояние системы, называются параметрами состояния. В химии чаще всего используются следующие параметры состояния: давление, температура, объем, состав системы. Описание системы не обязательно требует знания всех параметров системы, если параметры связаны между собой, т.е. зависят друг от друга.
Первый закон термодинамики и следствия из него. Химические реакции обычно протекают при постоянном давлении (например, в открытой колбе) или при постоянном объеме (в автоклаве), то есть являются соответственно изобарными и изохорными процессами.
При любом процессе соблюдается закон сохранения и превращения энергии. Первый закон, или первое начало термодинамики - это закон сохранения и превращения энергии в применении к тепловым процессам (т.е. к процессам, связанным с превращением теплоты и работы).
Первое начало термодинамики может быть сформулировано следующим образом: в любом процессе приращение внутренней энергии системы ∆U = U2 – U1 равно количеству сообщаемой системе теплоты Q минус количество работы А, совершаемой системой: ∆U = Q - А.
Теплота и работа функциями состояния не являются, ибо они служат формами передачи энергии и связаны с процессом, а не состоянием системы. При химических реакциях А - это работа против внешнего давления, то есть в первом приближении А = p∆V, где ∆V - изменение объема системы (V2 – V1). Так как большинство химических реакций проходит при постоянном давлении, то для изобарно-изотермического процесса (р = const, Т = const) теплота Qp будет равна:
Qp = ∆U + p∆V;
Qp = (U2 - U1) + p(V2 – V1);
Qp = (U2 + pV2) - (U1+ pV1).
Сумму U + pV обозначим через Н, тогда Qp = Н2 – Н1 = ∆H. Величину Н называют энтальпией. Таким образом, теплота (при р = const и Т = const) приобретает свойство функции состояния и не зависит от пути, по которому протекает процесс. Отсюда теплота реакции в изобарно-изотермическом процессе Qp равна изменению энтальпии системы ∆H (если единственным видом работы является работа расширения) Qp = ∆H.
Энтальпия (Н), как и внутренняя энергия (U), является функцией состояния, ее изменения (∆H) определяются только начальными и конечными состояниями системы и не зависят от пути перехода.
Нетрудно видеть, что теплота реакции в изохорно-изотермическом процессе Qv, (V= const и Т= const), при котором ∆V= О, равна изменению внутренней энергии системы ∆U: Qv = ∆U.
Теплоту химических процессов, протекающих при Р = const, Т = const и V = const называют тепловым эффектом. Это количество теплоты, которое выделяется или поглощается в ходе химических реакций.
Опытным путем тепловые эффекты химических реакций определяют в специальных приборах, называемых калориметрами. Для расчета количества теплоты используют формулу Q = cm(t2 – t1) или Q = cmDt, где Q - количество теплоты, c – теплоемкость, m – масса, Dt – изменение температуры. Тепловой эффект процесса обычно относят к 1 молю вещества: DH = – Q / u, где u – количество молей вещества. Если масса берется в кг, Q измеряется в кДж.
При экзотермических реакциях энтальпия системы уменьшается и ∆H<О (Н2 < H1), (Q>0), а при эндотермических - увеличивается и ∆H>О (Н2> Н1), (Q<0). В дальнейшем тепловые эффекты всюду выражаются через ∆H.
В основе термохимических расчетов лежит закон Гесса (1841 г.): тепловой эффект (энтальпия) реакции зависит от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, т.е. от числа и характера промежуточных стадий.
Следствия из закона Гесса позволяют теоретически рассчитывать тепловые эффекты химических реакций (приложения 5, 8).
Следствие 1. Энтальпия образования и энтальпия разложения одного моля сложного вещества равны по абсолютной величине, но противоположны по знаку.
Н2(г) + 1/2О2(г) = Н2О(г) rH0реак.= - 241,9 кДж,
Н2О(г) = Н2(г) + 1/2 О2(г) rH0реак.= + 241,9 кДж.
Под энтальпией образования понимают тепловой эффект реакции образования 1 моля вещества из простых веществ. Обычно используют стандартные энтальпии (теплоты) образования (приложение 8). Энтальпия образования для стандартных условий обозначается DН0обр. (или латинский вариант - DН0f, где f – первая буква слова formation - образование) и называется стандартной энтальпией. За стандартные условия принимают давление 101, 325 кПа и температуру 298, 15 K (25 oС).
Следствие 2. Энтальпия химической реакции ∆H0 x.p. (при стандартных условиях) равна разности между энтальпиями образования продуктов реакции ∑ H обр.прод и энтальпиями образования исходных веществ ∑ H обр.исх с учетом их стехиометрических коэффициентов ni
rH0реак. = SnirH0обр.прод. - SnirH0обр.реаг.
где S - условное обозначение суммы. Например, для реакции
аА + bВ ® сС + dD,
rH0реак. = (crH0обр.C + drH0обр.D) - (arH0обр.A + brH0обр.B),
где А, В и С, D - реагенты и продукты реакции, соответственно;
а, b, с, d - соответствующие стехиометрические коэффициенты при реагентах и продуктах реакции;
rH0обр.a, rH0обр.в, rH0обр.с, rH0обр.d - энтальпии образования реагентов и продуктов реакции.
Второй закон термодинамики утверждает, что всякий самопроизвольный процесс в изолированной системе связан с увеличением энтропии. Равновесие характеризуется максимумом энтропии: DS ≥ 0, т. е. изменение энтропии является критерием возможности самопроизвольного протекания процесса, но только для изолированной системы. Энтропия (S) отражает движение частиц веществ и является мерой неупорядоченности системы.
Изменение энтропии в результате химической реакции или фазового превращения равно разности сумм абсолютных значений энтропий продуктов реакции и суммой абсолютных значений энтропий исходных веществ в уравнении реакции:
DSx.p. = е S 0продуктов – е S 0исходных.
Абсолютные значения энтропий веществ приведены в справочных таблицах при стандартных условиях.
В химических процессах одновременно действуют две тенденции: стремление частиц объединиться за счет прочных связей в более сложные, что уменьшает энтальпию системы, и стремление частиц разъединиться, что увеличивает энтропию. Проявляется действие двух прямо противоположных факторов – энтальпийного (DH) и энтропийного TDS (т. к. энтропия растет с повышением температуры). Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных T и Р, отражает изменение энергии Гиббса (свободной энергии) DG: DG = DH – TDS.
Свободная энергия Гиббса (потенциал Гиббса) – DGхарактеризует возможность протекания реакции (термодинамическую возможность) в конкретных условиях для изобарно-изотермического процесса (Р = const, T = const)
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности или невозможности осуществления процесса. Самопроизвольно протекают реакции, если энергия Гиббса в исходном состоянии системы больше, чем в конечном: DG < 0. Увеличение энергии Гиббса (DG > 0) свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях. Если же DG = 0 и DH = TDS, то система находится в состоянии химического равновесия. В соответствии с уравнением DG = DH – TDS самопроизвольному протеканию процесса способствует уменьшение энтальпии и увеличение энтропии системы, т.е. когда DH < 0 и DS > 0 (DG < 0 при любых температурах). Из этого же уравнения видно, что самопроизвольно могут протекать процессы, для которых DH > 0 (эндотермические). Это возможно, когда DS > 0, но |TDS| > |DH| и тогда DG < 0 (высокие температуры). Если реакции экзотермические (DH < 0) и DS < 0, то процесс может протекать самопроизвольно (термодинамически возможен, DG > 0) при низких температурах.
Пример 1. Прямая или обратная реакция будут протекать при стандартных условиях в системе CH4(г)+CO2(г) ↔ 2CO(г)+2H2(г)? Ответ мотивируете, вычислив DG 0298 прямой реакции, исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ (см. прил. 5).
Решение. DG0x.p. = DH0x.p. – TDS0x.p.; DH и DS – функции состояния, поэтому DH 0x.p.= еDH0обр.(продуктов)- еDH0обр.(исходных веществ), т. е. изменение энтальпии реакции (при стандартных условиях) равно сумме энтальпий образования продуктов реакции минус сумма энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
DH0.x..p = (2·DH0co + 2·0) – (DH0CH4 + DH0CO2); DH0x.p. = 2(-110,5) + 2·0 – (–74,85 – 393,5) = 247,35. DH0H2 = 0 (энтальпия образования простых веществ равна нулю). Изменение энтропии реакции (при стандартных условиях) равно сумме абсолютной энтропии продуктов реакции минус сумма энтропий исходных веществ с учетом стехиометрических коэффициентов:
D S 0x.p. = е S 0продуктов – е S 0исходных веществ;
D S 0x.p. = (2 S 0 CO + 2 S 0 H 2) – (S 0 CH 4+ S 0 CO 2);
D S 0x.p. = (2·197,91 + 2·130,59) – (186,19 + 213,65) = 257,16 Дж/моль·град или 0,25716 кДж/моль·град.
Изменение энергии Гиббса (свободной энергии) при стандартных условиях равно DG0x.p.= 247,35 – 298·0,25716 = +170,63 кДж. То, что DG0298 > 0 указывает на невозможность самопроизвольного протекания прямой реакции при T = 298 К и равенства давлений взятых газов 1,013·105 Па.
Пример 2. Уменьшается или увеличивается энтропия при следующих переходах: 1) Льда в жидкое состояние (воду); 2) Кислорода O 2 в озон O 3? Почему? Вычислите D S 0298 для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях.
Решение.
1. При изменении энтропии в случае перехода льда в жидкое состояние равно
D S 0ф.п. = S 0 H 2 0 (ж) – S 0 H 2 O (к);
D S 0ф.п. = 69,96 – 39,33 = 30,63 Дж/моль·град.
2. Изменение энтропии при превращении кислорода в озон равно
D S 0превр. = S 0 O 3 – S 0 O 2;
D S 0превр = 237,6 – 205,03 = 31,57 Дж/моль·град.
Энтропия — есть мера неупорядоченности состояния вещества. Лед имеет кристаллическую структуру, в которой молекулы воды расположены упорядоченно и могут находиться лишь в определенных точках пространства. Так как степень беспорядка в жидком состоянии возрастает, изменение энтропии (D S 0превр.) также является положительной величиной, т. е. D S 0превр.>0. Из сравнения состава молекул O 2 и O 3 видно, что при переходе кислорода в менее устойчивую форму O 3 число атомов кислорода в молекуле увеличилось. Это значит, что значение энтропии O 3 должно быть больше, чем у O 2 и поэтому изменение энтропии аллотропического превращения больше нуля.
Контрольные вопросы
65. Прямая или обратная реакция будет протекать при стандартных условиях в системе
2NO(г) + O2(г) 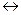 2NО2(г)? Ответ мотивируйте, вычислив ∆G°298 прямой реакции, исходя из значений стандартных теплот образования и стандартных абсолютных энтропий соответствующих веществ.
2NО2(г)? Ответ мотивируйте, вычислив ∆G°298 прямой реакции, исходя из значений стандартных теплот образования и стандартных абсолютных энтропий соответствующих веществ.
66. При какой температуре наступит равновесие системы
СН4(г) + СО2(г) = 2СО(г) + 2Н2(г); ∆Н = + 247,37 кДж?
67. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция
Н2(г) + СО2(г) = Н20(ж) +СО(г); ∆H = - 2,85 кДж. Зная тепловой эффект реакции и стандартные абсолютные энтропии соответствующих веществ, определите ∆G°298 этой реакции.
68. Уменьшается или увеличивается энтропия при следующих переходах: а) воды в пар; б) графита в алмаз. Почему? Вычислить ∆S°298 для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях.
69. Вычислите изменение энтропии в результате реакции образования аммиака из азота и водорода. При расчете можно исходить из ∆S°298 соответствующих газов, так как ∆S0 с изменением температуры изменяется незначительно. Чем можно объяснить отрицательные значения энтропии?
70. При сжигании 1 г гидразина N2H4 в калориметрической бомбе температура калориметра повысилась на 1,17 °С. Если калориметр имеет теплоемкость 16,53 кДж/кг град, то какое количество теплоты выделяет при сгорании 1 моль N2H4?
71.Выполнить расчет термодинамических функций химической реакции согласно условиям в таблице 3. Порядок выполнения расчета приведен в приложении 9.
Таблица 3. Варианты заданий к контрольному вопросу № 71.
| № п/п | Реакция | Т, К | Количество вещества | |
| Масса | Объем | |||
| Fe3O4(т) +H2(г) = 3FeO(т) +H2O(г) | 10 кг FeO | |||
| H2(г) +CO2 = H2O(г) + CO(г) | 10 л CO2 | |||
| CO(г) + FeO(т) = CO2(г) +Fe(т) | 2 л CO2 | |||
| CH4(г) + CO2(г) = 2CO(г) + 2H2(г) | 4 л CO | |||
| PbO(т) + H2(г) =Pb(т) +H2O(г) | 1 кг PbO | |||
| 2CuCl(т) + H2(г) = 2Cu(т) + 2HCl(г) | 2 л H2 | |||
| CaCO3(т) = CaO(т) + CO2(г) | 7 л CO2 | |||
| MgCO3(т) = MgO(т) + CO2(г) | 100 л CO2 | |||
| 2PbSO4(т) = 2PbO(т) + 2SO2(г) + O2(г) | 20 кг SO2 | |||
| Ca(OH)2(т) = CaO(т) + H2O(г) | 5 кг CaO | |||
| 3Fe2O3(т) = 2Fe3O4(т)+ 1/2O2 (г) | 7 кг Fe2O3 | |||
| FeO(т) + H2(г) = Fe(т) + H2O(г) | 10 л H2 | |||
| Fe3O4(т) + 4H2(г) = 3Fe(т) + 4H2O(г) | 2 л H2 | |||
| C(графит) + 2H2O(г) = CO2(г) + 2H2(г) | 1 кг C | |||
| Al2O3(т) + C(графит) = 2Al(т) +3CO(г) | 5 моль Al2O3 | |||
| Fe3O4(т) + 4CO(г) = 3Fe(т) + 4CO3(г) | 1 кг Fe | |||
| Mg(т) + CO2(г) = MgO(т) + CO(г) | 1 кг Mg | |||
| TiCl4(ж) + 2Mg(т) = Ti(т) + 2MgCl2(г) | 10 кг Ti | |||
| Al2O3(т) + 3C(графит) = 2Al(т) + 3CO(г) | 3 л CO | |||
| H2S(г) + 3/2O2(г) = H2O(г) + SO2(г) | 1 л H2S | |||
| H2(г) + 1/2O2(г) = H2O(г) | 1 л O2 | |||
| 2CO2(г) + H2O(г) = C2H2(г) + 1/2O2(г) | 2 л C2H2 | |||
| H2O2(г) = H2O(г) + 1/2O2(г) | 2 л H2O | |||
| C(алмаз) ®С(графит) | 1кг C(графит) | |||
| CaO(т) + CO2(г) + CaCo3(т) | 2 л CO2 | |||
| 2NaHCO3(т) = Na2CO3(т) + CO2(г) + H2O(г) | 5 кг Na2CO3 | |||
| C2H4(г) + H2(г) = С2H6 | 1 л C2H4 | |||
| KClO3(т) = KCl(т) + 3/2O2(г) | 2 л O2 | |||
| 2Al(т) + 3Cl2(г) = 2AlCl3(т) | 1 кг Al | |||
| Fe2O3(т) + 3CO(г) = 3CO2(г) + 2Fe(т) | 6 кг Fe |
Примечание, (г) - газ, (ж) - жидкость, (к) - кристаллическое (твердое) вещество.
 2015-03-22
2015-03-22 4722
4722
