Электрохимическими называются процессы, связанные с взаимным превращением электрической и химической энергий.
В металле всегда существует подвижное равновесие
Me «Men+ + ne.
При погружении металла в раствор электролита или воду ионы его поверхностного слоя под действиям полярных молекул растворителя (воды) начинают переходить в раствор:
Men+ + mH2O→ Men+× mH2O (гидратированные ионы металла).
Переход ионов металла в раствор сопровождается образованием избытка электронов на поверхности металла, т. е. металл заряжается отрицательно, а раствор вокруг металла – положительно. Пришедшие в раствор ионы металла вследствие притяжения к отрицательно заряженному металлу располагаются вблизи его поверхности, образуя так называемый двойной электрический слой.
Разность потенциалов, возникшая между металлом и раствором, называется электродным потенциалом металла EMe. Переход ионов металла в раствор заканчивается установлением равновесия Me + mH2O «Men+· mH2O + n.
Практически получается, что активные металлы заряжаются в растворах своих солей отрицательно, а менее активные – положительно. При этом активные металлы будут иметь тем больший отрицательный заряд, чем выше активность металла. И наоборот, неактивные металлы будут иметь тем больший положительный заряд, чем меньше их активность. Следовательно, величина электродного потенциала может служить мерой химической активности металлов. Для сравнения металла по активности электродные потенциалы их измеряют при стандартных условиях: при 25°С металл погружают в раствор его соли с концентрацией ионов металла 1 моль/л. Абсолютную величину электродного потенциала измерить не удается, поэтому определяют относительные значения, измеренные относительно электрода, принятого за эталон. Эталоном сравнения принят стандартный водородный электрод.
Разность потенциалов между металлом, погруженным в раствор его соли с концентрацией ионов в 1 моль/л, и стандартным водородным потенциалом называется стандартным потенциалом металла E0Me.
Расположив все металлы по возрастающей величине E0Me, получим ряд стандартных электродных потенциалов металлов (приложение 7).
Каждый металл может вытеснять из растворов солей все металлы, которые следуют за ним в этом ряду. Металлы, потенциалы которых отрицательны, могут вытеснять водород из растворов кислот.
Величина электродного потенциала металла определяется природой металла, активностью его ионов в растворе, т. е. их концентрацией. Зависимость величины электродного потенциала от концентрации ионов металла в растворе выражается формулой Нернста:
EMe = E0Me + (0,059 / n)lg C,
где E0Me – стандартный потенциал металла (В);
n – заряд иона металла (валентность);
C – концентрация гидратированных ионов металла (моль/л);
Химические источники тока. Гальванические элементы – это устройства, в которых химическая энергия окислительно-восстановительной реакции превращается в электрическую.
Действия их основаны на особенностях одних металлов восстанавливать другие из растворов их солей. Зная электродные потенциалы металлов, можно рассчитать электродвижущую силу (ЭДС) любого элемента, состоящего из двух металлов, погруженных в растворы их солей. Например, в медно-цинковом гальваническом элементе цинк, являясь более активным металлом (Е0Zn/Zn2+, < E0Cu/Cu2+), окисляется (анод -), а на медном электроде будут восстанавливаться ионы меди из раствора и он будет катодом (+) в данном элементе.
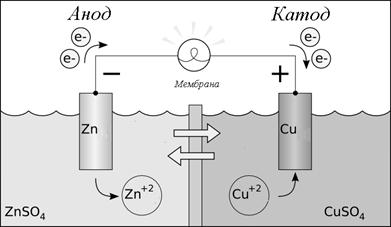
Рис. 1. Гальванический элемент Даниэля-Якоби
Необходимые для этого электроны будут перемещаться по внешней цепи от анода к катоду.
Схема такого элемента
(-) Zn| ZnSO 4 || CuSO 4 | Cu (+) или
(-) Zn| Zn 2 + || Cu 2+ | Cu (+).
Zn 0 –2 e → Zn 2 + , Cu 2 + + 2 e → Cu 0.
В любом гальваническом элементе (рис. 2) анодом будет более активный в данной паре металл. В процессе работы анод всегда разрушается (окисляется), посылая ионы в раствор. Менее активный металл будет катодом, на нем восстанавливаются ионы из раствора.
Электродвижущей силой (ЭДС) гальванического элемента называется разностью потенциалов его электродов:
ЭДС = E катода – E анода. В данном случае (при стандартных условиях)
ЭДС = E0Cu+2/Cu+ – E0Zn+2/Zn+ = 0,34 – (– 0,76) = 1,1В.
ЭДС гальванического элемента можно вычислить по уравнению Нернста:
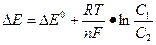
где D E - ЭДС гальванического элемента; D E0- стандартная ЭДС; R - универсальная газовая постоянная, равная 8,316 Дж/(моль·К); Т - температура, К; п — число электронов, переносимых в окислительно-восстановительной реакции; F - постоянная (число Фарадея), равная 96500 К; C1 и C2 - концентрации ионов соответствующих металлов в растворе. Стандартную ЭДС гальванического элемента можно подсчитать, если из стандартного электродного потенциала катода вычесть стандартный электродный потенциал анода:
DE0 = DE0кат. - DE0 ан
Величина ЭДС работающего гальванического элемента всегда меньше, чем рассчитанная по формуле Нернста, вследствие поляризации электродов (изменения их потенциалов при работе гальванического элемента).
Разновидностью гальванических элементов являются концентрационные и топливные элементы.
Электролиз. Электролизом называется совокупность процессов, происходящих при прохождении электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита. Электрод, на котором происходит восстановление, называется катодом; а тот, на котором происходит окисление, называется анодом. Но при электролизе катод заряжен отрицательно, а анод – положительно, т.е. распределение знаков заряда противоположно тому, которое имеется при работе гальванического элемента. Причина этого заключается в том, что процессы, протекающие при электролизе, обратны, идущим при работе гальванического элемента. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нем окислительно-восстановительной реакции превращается в электрическую.
Химические реакции, протекающие при электролизе, зависят от растворенного электролита, растворителя и материала электродов. Химические превращения за счет внешней электрической энергии, осуществляются в электролизерах.
Различают электролиз с инертными и активными анодами. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза (платина, иридий, графит, уголь, в определенных условиях - железо, никель, золото, свинец, алюминий и др.), а активным - анод, материал которого может окисляться в ходе электролиза.
Какие электрохимические процессы будут протекать у электродов, прежде всего зависит от соотношения электродных потенциалов соответствующих электрохимических систем (приложение 6 и 7). На катоде восстанавливаются электрохимические системы, имеющие наибольшее значение электродного потенциала, а на аноде окисляются электрохимические системы с наименьшим электродным потенциалом.
Электролиз расплавов. При электролизе расплавленного NaCl ионы Na+ присоединяют электроны на отрицательном электроде и восстанавливаются. По мере уменьшения концентрации ионов Na + вблизи этого электрода к нему мигрируют дополнительные ионы Na+. Точно так же происходит и перемещение ионов С1- к положительному электроду, где они отдают электроны и окисляются.
В рассматриваемом случае в электролитической ячейке протекают следующие реакции:
на аноде: 2С1- ® С12 + 2е
на катоде: 2Na+ + 2е ® 2Na
2Na+ + 2С1- ® 2Na + СI2 (г.)
Электролиз водных растворов. При рассмотрении электролиза водных растворов нельзя упускать из виду, что во всяком водном растворе кроме ионов электролита имеются еще и ионы, являющиеся продуктами диссоциации воды – H+ и OH –. В электрическом поле ионы водорода перемещаются по катоду, а ионы OH - – к аноду. Таким образом, у катода могут разряжаться как катионы электролита, так и катионы водорода. Аналогично у анода может происходить разряд как анионов электролита, так и гидроксид-ионов. Кроме того, молекулы воды также могут подвергаться электрохимическому окислению или восстановлению.
Рассматривая катодные процессы, протекающие при электролизе водных растворов, ограничимся важнейшим случаем – катодным восстановлением, приводящем к выделению элементов в свободном состоянии. Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода и в случае нейтральных растворов (pH = 7) имеет значение E0 = - 0,41 В. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положительнее, чем -0,41 В,то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода (начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем – 0,41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений, включительно до титана. Наконец, если потенциал металла близок к величине – 0,41 В (металлы средней части ряда – Zn, Cr, Fe, Cl, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода.
Электрохимическое выделение водорода из кислых растворов происходит вследствие разряда ионов водорода. В случае же нейтральных или щелочных сред оно является результатом электрохимического восстановления воды: 2H2O+2e-=H2+2ОH-.
Таким образом, характер катодного процесса при электролизе водных растворов определяется прежде всего положением соответствующего металла в ряду напряжений. В ряде случаев большое значение имеютрН раствора, концентрация ионов металла и другие условия электролиза.
При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза. Активным называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для инертных анодов чаще всего применяют графит, уголь, платину. На инертном аноде при электролизе водных растворов щелочей, кислородосодержащих кислот и их солей, а также фтороводорода и фторидов происходит электрохимическое окисление воды с выделением кислорода. В зависимости отрН раствора этот процесс протекает по-разному и может быть записан различными уравнениями. В щелочной среде уравнение имеет вид
4OН- = 2O0+2H2O +4e,
а в кислой или нейтральной:
2Н2O =2O0+4H++4e.
В рассматриваемых случаях электрохимическое окисление воды является энергетически наиболее выгодным процессом. Кислородсодержащие анионы или не способны окисляться, или их окисление происходит при очень высоких потенциалах.
Пример 1. Составьте схему двух гальванических элементов: а) медь-катод; б) медь-анод. Напишите уравнение реакции, происходящих при работе этих элементов, определите значение стандартной ЭДС.
Решение. а) Медь является катодом. В этом случае схему можно изобразить так:
(Анод -) Zn° | Zn(N03)2|| CH(NO3)2 | Cu° (Катод +)
Гальванический элемент состоит в данном случае из цинкового и медного электродов, опущенных в растворимые соли соответствующих металлов, при концентрации ионов этих металлов равных единице. Электроды соединяются металлическим проводником. Более активный металл (потенциал которого ниже) выполняет роль анода, на нем протекает анодный процесс.
На аноде: Zn° - 2е → Zn2+ (восстановитель цинк) происходит процесс разрушения (растворения) цинка.
На катоде: Сu2+ + 2е → Сu0 (окислитель ионы меди) происходит процесс восстановления ионов меди Сu2+ из раствора.
ЭДС = Е° окислитель - Е° восстановитель = 0,34- (- 0,765) = 1,11 В.
б) Медь является анодом
(Анод -) Сu° | Cu(NO3) || AgNO3 | Ag° (Катод +)
На аноде: Сu0- 2е → Сu2+ (восстановитель) окисление меди.
На катоде: Ag+ + е → Ag° (окислитель) восстановление ионов серебра.
Пример 2. В каком направлении будут перемещаться электроны во внешней цепи гальванического элемента. Какой металл будет растворяться в соответствующей схеме: Mg° | Mg2+|| Сu2+ | Сu0
Решение. Электроны во внешней цепи гальванического элемента будут перемещаться от Mg0 (магния) к меди. При соединении магниевого и медного электродов металлическим проводником Mg° - 2е →Mg2+, так как магний имеет более низкое значение электродного потенциала, следовательно он и будет растворяться и переходить в раствор, содержащий ионы Mg2+, также в виде ионов Mg 2+.
Пример 3. От чего зависит значение электродного потенциала?
Решение. Согласно уравнению Нернста: Е = Е° + (RT / Fn) • ln С,
величина электродного потенциала зависит от температуры Т и концентрации С, тo есть чем выше температура и концентрация ионов, тем выше значение электродного потенциала.
Пример 4. Электролиз раствораCuCl2 с инертным анодом.
Решение. Медь в ряду напряжений расположена после водорода, поэтому у катода будет происходить разряд ионов Сu2+ и выделение металлической меди(II). У анода будут разряжаться хлорид-ионы.
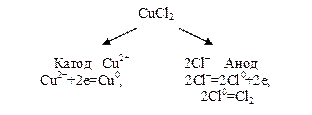
Пример 5. Электролиз раствора K2SO4 с инертным анодом.
Решение. Поскольку калий в ряду напряжений стоит значительно раньше водорода, то у катода будет происходить выделение водорода и накопление ионовОН-У анода будет идти выделение кислорода и накопление ионов Н+. В то же время в катодное пространство будут приходить ионы К+, а в анодное – ионы SO–4.
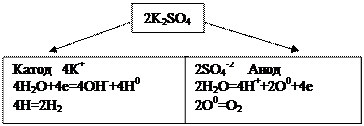 |
Таким образом, раствор во всех его частях будет оставаться электронейтральным. Однако в катодном пространстве будет накапливаться щелочь, а в анодном – кислота.
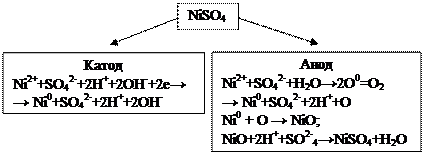 |
Пример 6. Электролиз раствора NiSO4 с никелевым анодом.
Решение. Стандартный потенциал никеля (–0,250 В) несколько больше, чем – 0,41 В, поэтому при электролизе нейтрального раствора NiSO4 на катоде в основном происходит разряд ионов Ni+ и выделение металла. На аноде происходит противоположный процесс – окисление металла, так как потенциал никеля намного меньше потенциала окисления воды, а тем более потенциала окисления иона SO42-. Таким образом, в данном случае электролиз сводится к растворению металла анода и выделению его на катоде.
Этот процесс применяется для электролитической очистки никеля (так называемое электролитическое рафинирование).
Контрольные вопросы
174. Составьте схемы двух гальванических элементов, в одном из которых металл служил бы катодом, а в другом анодом. Напишите уравнения реакций, происходящих при работе, этих элементов и вычислите значения стандартных ЭДС:
а) никель - катод; никель - анод
б) кобальт - катод; кобальт - анод
в) железо - катод; железо - анод
г) цинк - катод; цинк - анод
д) серебро - катод; серебро - анод
е) свинец - катод; свинец - анод
ж) магний - анод; магний - катод
з) цинк - анод; цинк - катод
и) железо - анод; железо - катод
к) кобальт - анод; кобальт - катод
л) олово - катод; олово - анод
м) никель - анод; никель - катод.
175. В каком направлении будут перемещаться электроны во внешней цепи следующих элементов? Какой металл будет растворяться в каждом из этих случаев? Схемы гальванических элементов следующие:
| a) Mg°| Mg2+ || Pb2+ | Pb° | е) Mg° | Mg2+ || Pb2+ | Pb° |
| б) РЬ° | РЬ2+ || Сu2+ | Сu0 | ж) Pb° | Pb2+ || Сu24 | Cu° |
| в) Fe° | Fe2+ || Sn2+ | Sn° | з) Zn° | Zn2+ || Pb2+ | Pb° |
| г) Ni° | Ni2+ || Cd2+ | Cd° | и) Cu° | Cu2+ || Ag+ | Ag° |
| д) Zn° | Zn2+ || Ni2+ | Ni° | к) Со°|Со2+ ||Ag+ | Ag° |
176. Как изменится потенциал цинкового электрода, если раствор соли цинка, в который он погружен, разбавить водой:
а) уменьшится;
б) увеличится;
в) не изменится.
177. Водородный электрод погружен в 1 М раствор соляной кислоты. Как изменится потенциал электрода, если раствор нейтрализовать щелочью:
а) уменьшится;
б) увеличится;
в) не изменится.
178. Железная пластина, погруженная в соляную кислоту, очень медленно выделяет водород, но если к ней прикоснуться цинковой проволокой, то она тотчас покрывается пузырьками водорода. Объясните эти явления. Какой металл переходит при этом в раствор?
179. Гальванический элемент состоит из серебряного электрода, погруженного в 1 М раствор нитрата серебра и нормального (стандартного) водного электрода. Какие химические процессы будут происходить у электродов этого элемента при его работе? Укажите величину его ЭДС.
180. Железные и цинковые пластины при погружении их в серную разбавленную кислоту, растворяются в ней с выделением водорода. Что изменится, если соединить их проволокой? Будут ли они обе растворяться? У поверхности, какой пластинки будет выделяться водород? Ответ мотивируйте.
181. Написать уравнения реакций, происходящих при электролизе следующих растворов:
| а) нитрат серебра | н) хлорида магния |
| б) нитрата свинца | о) хлорида марганца |
| в) гидроксида калия | п) сульфата никеля |
| г) сульфата цинка | р) иодида калия |
| д) нитрата меди | с) хлорида аммония |
| е) сульфата алюминия | т) раствора серной кислоты |
| ж) сульфата калия | у) нитрата кальция |
| з) гидроксида калия | ф) сульфата магния |
| и) хлорида алюминия | х) хлорида меди (II) |
| к) сульфата натрия | ц) бромида серебра |
| л) иодида калия | ч) иодида натрия |
| м) хлорида калия | щ) сульфата меди |
 2015-03-22
2015-03-22 6810
6810
