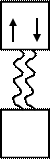
Свободная орбиталь атома акцептора
Атом, предоставляющий электронную пару, называется донором, а принимающий ее на свою свободную орбиталь - акцептором.
Примером возникновения ковалентной связи по донорно-акцепторному механизму является образование иона аммония из молекулы аммиака и иона водорода:
NH3 + H+ → NH4+.
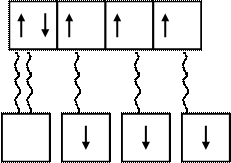
В молекуле аммиака 3 неспаренных электрона атома азота образуют три валентных связи с тремя атомами водорода по обычному механизму образования ковалентной связи. Неподеленная электронная пара 2 s атома азота (донор) заняла свободную орбиталь иона водорода (акцептор), образующегося при диссоциации молекулы кислоты, например, HCI.
2 s 2 p
 N
N
Донорно-акцепторный обычный механизм
 2015-03-27
2015-03-27 764
764








